KÜTÜPHANEKÜTÜPHANE
Kedi Enfeksiyöz Peritoniti (FIP) Tanı Koyma Rehberi
Vicki Thayer(1,*), Susan Gogolski(2), Sandra Felten(3), Katrin Hartmann(4), Melissa Kennedy(5), Glenn A Olah(6)
(1)Purrfect Practice PC, Lebanon, OR, USA
(2)Colorado State University, Fort Collins, CO, USA
(3)Ludwig-Maximilians-University, Munich, Germany
(4)Ludwig-Maximilians-University, Munich, Germany
(5)University of Tennessee, Knoxville, TN, USA
(6)Albuquerque Cat Clinic, Albuquerque, NM, USA
Uluslararası Kedi Hekimliği Derneği (ISFM), AAFP ve EveryCat Health Foundation'ın bu rehberde yer alan tavsiyeleri desteklemekten memnuniyet duymaktadır.
Eylül 2022
Çeviri: Ece Yağcı
Klinik bakımdan taşıdığı önem: Kedi enfeksiyöz peritoniti (FIP) kedilerde en önemli bulaşıcı hastalıklardan ve ölüm nedenlerinden biridir; özellikle 2 yaşından küçük genç kediler bu hastalığa karşı savunmasızdır. FIP'e kedi koronavirüsü (FCoV) neden olmaktadır. Veterinerlik hizmeti veren kurumlarda kedi ölümlerinin yaklaşık %0,3 ila %1,4'ünün FIP'den kaynaklandığı tahmin edilmektedir.
Amaç: Bu makale, kedi hastalıkları uzmanlarından oluşan bir Geçici Çalışma Grubu tarafından 2022 AAFP/EveryCat Kedi Enfeksiyöz Peritoniti Tanısı Koyma Rehberi başlığıyla veteriner hekimlere FIP semptomları gösteren kedilere tanı koymada yardımcı olacak temel bilgileri sunmak amacıyla hazırlanmıştır.
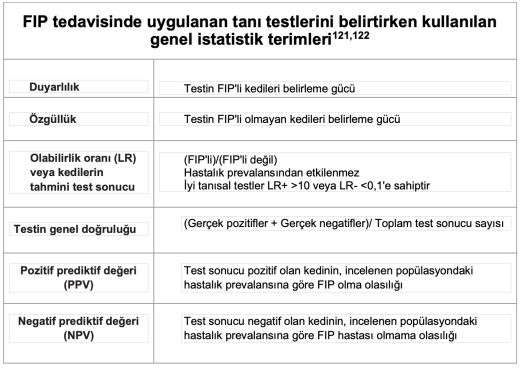
Analiz ve değerlendirme: Neredeyse her küçük hayvan veteriner hekimi bu tür vakalarla karşılaşacaktır. Patognomonik klinik bulguların veya laboratuvar testlerinde herhangi bir değişikliğin görülmemesi nedeniyle, özellikle de effüzyon yoksa, FIP'i teşhis etmek zor olabilir. FIP için vaka hazırlarken her bir tanı testinin duyarlılığı, özgüllüğü, tahmin değeri, olasılık oranı ve tanısal doğruluğunun iyice anlaşılması çok önemlidir. Herhangi bir tanı testine veya ticari laboratuvar araştırmasına başlamadan önce, klinisyen "neden bu test?" ve "elde edilen sonuçlar ne anlama geliyor?" gibi sorulara cevap verebilmelidir. Sonuç olarak, FIP teşhisine yönelik izlenecek yaklaşım, her bir kedinin kendine özgü sunumuna göre şekillendirilmelidir.
Önemli: Hastalığın tedavi edilmediğinde ölümcül olduğu göz önüne alınırsa, doğru tanıyı koymak son derece kritiktir. Klinisyen, şüphe indeksini "adım adım" oluşturmak için tanı testlerini ve numune türlerini seçerken hastanın bireysel öyküsünü, belirtilerini ve detaylı fizik muayene bulgularını da göz önünde bulundurmalıdır. Yapılan araştırmalar yeni antivirallerin FIP tedavisindeki etkinliğini ortaya koymuş olsa da bu ürünler şu anda birçok ülkede yasal olarak temin edilememektedir. Geçici Çalışma Grubu, veteriner hekimleri literatürü incelemeye ve klinik çalışmalar neticesinde onaylanan yeni ilaçları araştırmayı tavsiye etmektedir.
Giriş
Kedi enfeksiyöz peritoniti (FIP) ilk kez 1963 yılında Dr. Jean Holzworth ve Boston, ABD'de Angell Memorial Hayvan Hastanesi'ndeki meslektaşları tarafından spesifik bir hastalık türü olarak tanımlanmıştır(1). Kalabalık ortamlarda yaşayan kedilerde kedi koronavirüsü (FCoV) enfeksiyonu prevalansı yüksek olduğundan, FIP genellikle geçici bakım yeri, barınaklar ve koruma/kurtarma alanlarından gelen kedilerde görülür(2). Yakın zamanda stresli bir olay geçiren kedilerde de FIP görülme olasılığı oldukça yüksektir. Buna ek olarak, genç kediler (2 yaşından küçük) özellikle bu hastalığa karşı savunmasızdır(3).
FIP, kedilerde görülen en önemli bulaşıcı hastalıklardan biridir ve neredeyse küçük hayvanlarla ilgilenen her veteriner hekimi, özellikle de barınaklar, kurtarma ekipleri ve/veya hayvan çiftlikleriyle yakın işbirliği içinde çalışanlar, bu tür vakalarla karşılaşacaktır. Daha karmaşık vakalar genellikle uzmanlar tarafından incelenir ve üniversite hastanelerinde tedavi edilir. Veterinerlik hizmeti veren kurumlarda kedi ölümlerinin yaklaşık %0,3 ila %1,4'ünün FIP'ten kaynaklandığı tahmin edilmektedir(3-5).
FIP'in teşhisi, özellikle effüzyon olmadığında, patognomonik klinik bulguların veya laboratuvar testlerinde herhangi bir değişikliğin görülmemesi nedeniyle oldukça zor olabilir. Ancak, hastalığın tedavi edilmediğinde ölümcül olduğu göz önüne alınırsa, doğru tanı koyabilmek son derece kritiktir.
2022 AAFP/EveryCat Kedi Enfeksiyöz Peritoniti Tanısı Koyma Rehberi veteriner hekimlere FIP semptomları gösteren kedilere tanı koymada yardımcı olacak temel bilgileri sunmak amacıyla kedi hastalıkları uzmanlarından oluşan Geçici Çalışma Grubu tarafından hazırlanmıştır.
FIP bir zamanlar ölümcül bir hastalık olarak kabul ediliyordu, ancak yapılan araştırmalar FIP tedavisinde yeni antiviral ilaçların etkin rol oynayabileceğini göstermiştir.
FCoV, bünyesinde çok sayıda türü barındıran iki serotipte (tip I ve II) görülür(9,10). FCoV serotipleri, nötrleyici antikor reaksiyonları açısından farklılık gösterir. Ayrıca spike (S) proteini dizilimleri de farklıdır(11-13). Tip II, çoğu kedi popülasyonunda tip I'e kıyasla daha az yaygındır(14,15) ve büyük olasılıkla FCoV tip I ile köpek koronavirüslerinin rekombinasyonundan meydana gelmiştir (bkz. ek şekil 2)(12,16-18). Serotip II, hücre girişi için bağırsak villuslarında19,20 bulunan kedi aminopeptidaz-N reseptörünü kullanırken, serotip I'in hücresel reseptörü hala bilinmemektedir(20,21) Serotip II FCoV hücre kültüründe kolayca üretilebilirken, serotip I FCoV'nin kültürlenmesi oldukça zordur.
FCoV, virülans açısından farklılık gösteren iki farklı biyo/pato tip olarak ortaya çıkar(9,22,23). Bunlar; birden fazla kedinin bulunduğu popülasyonlarda çok yaygın olarak görülen, mutasyona uğramamış zararsız biyotip (kedi enterik koronavirüsü [FECV] olarak da adlandırılır) ve FIP'e neden olan mutasyona uğramış virülan biyotip (kedi enfeksiyöz peritoniti virüsü [FIPV] olarak da adlandırılır) şeklinde tanımlanmaktadır. Enfeksiyon daima mutasyona uğramamış biyotipi de beraberinde getirir, fakat FCoV ile enfekte olan kedilerin küçük bir kısmında (birden fazla kedinin bulunduğu ortamlarda %7 ila %14) spontane gelişen mutasyonlar, hücre tropizminin enterositlerden monositlere/makrofajlara doğru değişim göstermesine neden olur(10,24-26). Bu biyotip değişimi FIP patogenezinde kilit bir noktadır. Aynı ortamdan gelen mutasyona uğramamış ve mutasyona uğramış FCoV biyotipleri >%99 oranında birbiriyle ilişkilidir, fakat virülansları benzersiz bir şekilde farklılık gösterebilmektedir(24).
Kedi Koronavirüs Enfeksiyonunun Epidemiyolojisi
FCoV dünya genelinde görülmekte ve kedi popülasyonlarının çoğunda yaygın olarak rastlanmaktadır(27,28). Oldukça bulaşıcıdır ve fekal- oral yolla bulaşarak hızla yayılır; bu da kedi yetiştirme çiftlikleri,2 barınak/kurtarma tesisleri ve hayvan toplama alanları gibi birden fazla kedinin bulunduğu ortamlarda yüksek prevalansa sebep olur(28). FCoV enfeksiyonu özellikle barınma şartları kalabalık olduğunda ve kum ila mama kapları paylaşıldığında yaygın olarak görülür (bkz. ek şekil 3)(29-34). Yapılan bir çalışmada, gerçek zamanlı ters transkriptaz- kantitatif polimeraz zincir reaksiyonu (RT- qPCR) ile 37 Alman kedi yetiştirme çiftliğindeki 179 kedide FCoV bulaşma prevalansının %77 olduğu tespit edilmiştir(2). Test edilen 37 kedi yetiştirme çiftliğinin hepsinde FCoV saptanmıştır. FCoV'nin tek bir kedi yetiştirme çiftliğinde ya da barınakta yayılması üzerine yapılan diğer çalışmalarda %74 ila %100 arasında değişen prevalanslar tespit edilmiştir(30,35).
ABD'nin Kaliforniya eyaletindeki barınaklara yerleştirilmeden önce ve yerleştirildikten sonra kediler üzerinde yapılan bir araştırmada, kabul sırasında FCoV bulaşma prevalansı tüm kedilerde %33, yavru ve 56 haftanın altındaki genç kedilerde ise %90 olarak tespit edilmiştir(36),bu prevalans, barınak ortamında birlikte bakıldıklarında, özellikle yetişkin kediler arasında, belirgin bir şekilde artış göstermiştir(36).
Başlangıçta, bir kedi FCoV ile enfekte olduğunda, virüs distal duodenumdan çekuma kadar uzanan ince bağırsak villuslarının matür apikal kolumnar epitel hücrelerinde replike olur(37). Bazı kedilerde, kolonik kolumnar epitel hücrelerde kalıcı enfeksiyon meydana gelir (bkz. ek şekil 4a)(30,38,39). Kediler ilk 7 gün içinde, genellikle enfeksiyondan 2 ila 3 gün sonra, virüsü bulaştırmaya başlar ve genellikle birkaç hafta boyunca bu durum devam eder; bazı kediler 18 aya kadar, hatta ömür boyu virüs bulaştırabilir(9,32,40). Virüsün bulaşma oranı özellikle enfeksiyonun ilk evresinde oldukça yüksektir(9,38); çoğu kedide viral yük daha sonra kademeli bir şekilde azalır ve virüsün bulaşması tamamen son bulabilir, fakat kedilerin hepsi tekrar enfeksiyon kapmaya yatkın kalır ve virüs bulaştırmaya devam ederler (9,30,32,36,41,42).
Kedilerden çok azı dirençli olup virüsü hiçbir zaman bulaştırmazlar.(9,17,30,32,36,40-42)
FCoV'nin endemik olarak görüldüğü birden fazla kedinin bulunduğu ortamlardaki yavru kediler genellikle yaşamlarının ilk haftalarında enfekte olurlar(9,40); nitekim FCoV enfeksiyonu 2 ila 4 haftalık küçük yavru kedilerde de görülmüştür(43). Bu gibi erken yaşta görülen enfeksiyonlar anneden geçen antikorların koruyuculuğu hakkında bazı soru işaretlerine yol açmıştır; yine de yavru kedilerin sütten erken kesilmesi tavsiye edilmemektedir(28,44).
1 yaşından küçük yavru kedilerin FCoV bulaştırma olasılığı yetişkin kedilere göre 2,5 kat daha fazladır(2). Ayrıca yavru kediler yaşlı kedilere göre genellikle çok daha fazla viral yük bulaştırırlar(2). 6 aylıktan küçük yavru kedilerin yüksek oranda virüs bulaştırması, bağışıklık sistemlerinin henüz olgunlaşmamış olması ve dolayısıyla virüsün hızlı bir şekilde çoğalması ile açıklanabilir(9,36). Genç kedilerin yüksek seviyede viral yük taşıması, çok daha yüksek seviyede viral replikasyon ve sonuç olarak da FCoV'nin giderek daha virülan bir biyotipe dönüşme riskinin artması demektir(9).
FIP patogenezindeki kilit nokta mutasyona uğramamış biyotipten mutasyona uğramış daha virülan FCoV biyotipine geçiştir.
Primer FCoV enfeksiyonu ile bağlantılı üç farklı senaryo belirlenmiştir(45):
❖Kediler enfeksiyona karşı oldukça dirençlidir, virüsün bulaşması hızlı bir şekilde son bulur ya da hiç bulaşmaz (yaklaşık %5);
❖ Kediler virüsü 2 ila 3 ay veya daha uzun süre, geçici olarak, düşük seviyede ve sadece belirli aralıklarla bulaştırırlar (yaklaşık %70-80);
❖ Kediler yüksek seviyede viral yükü uzun süre kalıcı olarak bulaştırılar (yaklaşık %10 ila %15).
FCoV'nin yüksek mutasyon oranı nedeniyle, enfekte kediler quasispecies (viral türümsü) veya mutasyon kümesi olarak bilinen, genetik olarak birbiriyle bağlantılı ancak farklı viral popülasyonlardan oluşan, bir yığın virüs bulaştırmaktadır. Enfekte kediler sürekli aynı veya farklı FCoV türleriyle yeniden enfekte olabilir(42,46). Kedi yetiştirme çiftliklerinde ve birden fazla kedinin bulunduğu diğer ortamlarda yapılan çeşitli çalışmalara göre herhangi bir zamanda en azından bir kedi diğerlerine FCoV bulaştırmaktadır(2,9,10,28,43,45).
Kaliforniya'daki barınaklara yerleştirilmeden önce ve yerleştirildikten sonra kediler üzerinde yapılan (yukarıda bahsi geçen) çalışmada, barınakta sadece bir hafta kaldıktan sonra bazı kedilere FCoV bulaşma oranı 10 ila 1 milyon kat artmıştır(36).
Birden fazla kedinin bulunduğu ortamlarda FCoV'un yaygın olarak görülmesi nedeniyle, sürekli FCoV bulaştıran kedileri tespit etmek, mümkünse savunmasız yavru kedi ve yetişkin kedilerde FCoV enfeksiyonunu ve dolayısıyla FIP riskini önlemek en önemli önceliklerden
biridir. Bu gibi durumlarda FCoV bulaştıran kedileri tespit etmek amacıyla, her kediye 1 hafta ile 1 ay arasında değişebilen zaman aralıklarıyla FCoV enfeksiyonu olup olmadığına bakmak için en az üç kez fekal RT- qPCR testi yapılmalıdır(2,28,31,41,45,47,48).
Düşük virülanslı FCoV ile enfekte olan kedilerin çoğu asemptomatik olduğundan tedavi edilmesine gerek olmazken, bazılarında gastrointestinal belirtiler (örn. hafif şiddetli kusma ve/veya ishal) görülebilir.46,49 Şayet böyle bir durum söz konusuysa, bu belirtiler genellikle kendi kendini sınırlar ve çok uzun sürmez(9,37,49). Fakat kedilerin az bir kısmında haftalarca ya da aylarca süren ishal görülebilir(9,49,50). 100 barınak kedisi üzerinde yapılan ve kedi enterik patojenlerini inceleyen bir çalışmada, 12 enterik patojen arasında FCoV'in ishalli kedilerde normal kedilere kıyasla belirgin bir şekilde daha yaygın görüldüğü tespit edilmiştir (sırasıyla %58 ve %36)(51).
FIP'in Patogenezi
RNA polimerazın yüksek hata oranı nedeniyle koronavirüs genomları çok sayıda genetik varyasyona sahiptir ve dolayısıyla genetik mutasyonlara yatkındır. FCoV'nin sistemik yayılımı bakımından, bir kedideki hücresel tropizm değişikliği (gastrointestinal epitelden monositlere / makrofajlara) ve monositlerin / makrofajların enfeksiyonuna yol açan mutasyonlar son derece önemlidir (bkz. ek şekil 4b)(26,52,53). Monosit/makrofaj girişinin olması FIP oluşumu için tek başına yeterli değildir; bunun için büyük olasılıkla monositler/makrofajlar içinde kalıcılığa, etkili bir şekilde replikasyona ve bunları aktive edecek mutasyonlara da ihtiyaç vardır (bkz. 'ön koşullar' bölümü)(54,55).
FCoV İLE ENFEKTE KEDİLERDE FIP OLUŞUMU İÇİN GEREKEN ÖN KOŞULLAR
❖ Kedilerde FCoV'nin internal mutasyonları, FCoV'nin hücre tropizminde gastrointestinal epitel hücrelerinden monositlere/makrofajlara geçişe neden olur;
❖ FIP'e bağlı virülan FCoV, monositlerde/makrofajlarda etkili bir şekilde replikasyon yeteneği kazanır ve böylece vücuda sistemik olarak hızla yayılır;
❖ FIP'e bağlı virülan FCoV ile enfekte monositlerin/makrofajların aktive olması,
belirgin bir şekilde sitokin üretilmesine ve bağışıklık sisteminin harekete geçmesine yol açar.
Patogenez hakkında daha fazla bilgi edinmek için ek dosya/şekil 4c, 4d, 5a, 5b ve 6'ya bakınız.


 Klasik tabloya uymayan vakalarda (örneğin, tek kedili bir evde yaşayan yaşlı bir kedi) ayırt edici tanı listesinde FIP yer almayabilir. Eşzamanlı hastalık mevcut olduğunda FIP'in gizli belirtileri de gözden kaçabilir.
Veteriner hekimlikte bir kedinin FIP hastası olduğuna dair kesin tanı koyma veya ölüm öncesinde şüphe indeksini yükseltme becerisi birçok çalışmanın odak noktası olmuştur(28,50,78,80,82-86). FIP tanısına ulaşmak için veteriner hekim, şüphe indeksini "adım adım" yükseltmek amacıyla hastanın öyküsünü, belirtilerini ve fizik muayene bulgularını göz önünde bulundurmalı ve tanısal testler ile numune tiplerini buna göre seçmelidir (Şekil 1). FIP tanısı koymaya çalışırken, kan (tam kan, serum, plazma, periferik kan mononükleer hücreleri [PBMC]), effüzyonlar (torasik, abdominal, perikardiyal), dokular, beyin omurilik sıvısı (CSF), aköz hümör ve/veya doku ince iğne aspiratları (FNA) ve biyopsiler dahil olmak üzere çeşitli örnek türleri üzerinde benzer veya farklı test yöntemleri kullanılabilir.
Belirtiler ve Hastanın Öyküsü
FIP'in patogenezi oldukça karmaşıktır ve bir kedide FIP'e yatkınlık virüse ait virülans faktörleri, genetik özellikler gibi konak faktörleri, FCoV'ye maruz kalındığı sırada kedinin yaşı, genç bir kedinin FCoV enfeksiyonuyla mücadele ettiği sırada eş zamanlı görülen hastalıklar ve/veya diğer stres faktörleri arasındaki karşılıklı etkileşimi kapsamaktadır(86-88).
Konak faktörleri, majör histokompatibilite kompleksi (MHC) çeşitliliği, sitokin üretimi ve lenfosit apoptozu dahil olmak üzere kedinin bağışıklık sistemi durumunu etkileyebilir. Örneğin, MHC II'nin bazı özellikleri bağışıklık sisteminin verdiği tepkinin kalitesini etkileyebilir(73,89). Ayrıca, sitokin ve reseptör bağlantılı tek nükleotid polimorfizmleri ile FIP'e karşı artan duyarlılık arasında bir bağlantı olduğu öne sürülmektedir(62).
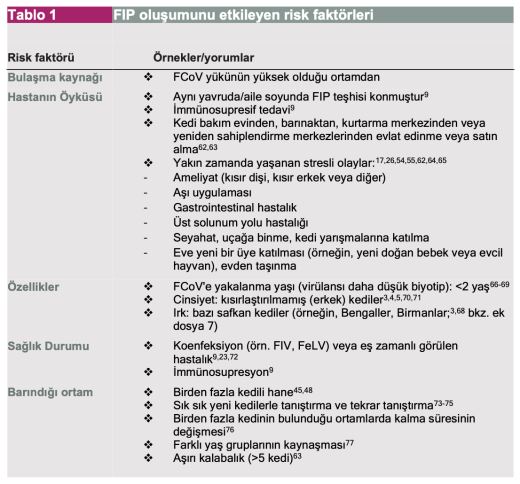
FIP oluşumu için kedinin belirtileri ve öyküsüyle ilgili bir dizi risk faktörü belirlenmiştir (Tablo 1'de listelenmiş ve aşağıda özetlenmiştir).
❖ Toplu yaşam alanı: Birden fazla kedinin bulunduğu ortamlarda, FCoV enfeksiyonlu kedilerin yaklaşık %12'sinde FIP ortaya çıkacaktır(90,91) ve virüsün birden fazla kedinin bulunduğu ortamlardan kaynaklanması önemli bir risk faktörüdür. Bununla birlikte, yapılan bir çalışmada(3), FIP teşhisi konulan kedilerin neredeyse üçte ikisi teşhis sırasında tek veya iki kedili evlerde yaşamaktaydı (bunun nedenlerinden biri, yeni bir eve katılmadan ve FIP oluşmadan önce FCoV'ye maruz kalmış ve uzun süre bu virüsü taşımış olmalarıdır).
❖ Yaş: FIP, ağırlıklı olarak 2 yaşın altındaki kedileri etkilemektedir(3-5,66-69). Avustralya(66) ve Kuzey Carolina, ABD'de(4) yapılan çalışmalarda, FIP'li kedilerin sırasıyla %55 ve %67'sinin 2 yaşından küçük olduğu rapor edilmiştir.
❖ Cinsiyet ve kısırlaştırma durumu: Yapılan bazı çalışmalarda erkek kedilerin FIP'e yatkın olduğu bulunmuştur(3,5,14,66,68).
Ayrıca, çeşitli çalışmalarda da kısır olmayan kedilerde, özellikle de erkeklerde bu riskin arttığı belirtilmiştir(4,5,92).
❖ Irk: FIP'li kediler arasında çok sayıda safkan kedi bulunmaktadır ve safkan kedilerde hastalığa karşı kalıtsal bir duyarlılık olduğu tartışılmaktadır(93). Kuzey Carolina'da yapılan çalışmada(4), safkan kedilerin yaklaşık %1,3'ünde FIP görülürken, melez kedilerde bu oran %0,35'tir; Avustralya'daki çalışmada ise FIP'li kedilerin %71'i safkandır(66). FIP, bazı kedi familyalarını etkileyebilmektedir(73) ve bulgular çalışmalar arasında farklılık gösterse de (bkz. ek dosya 7), belirli ırklar bu hastalığa daha fazla/daha az yatkın veya hastalık bu ırklarda daha fazla/daha az oranda görülmektedir (3,68).
❖ Stres: Stresin FIP riskini artırdığı da öne sürülmüştür(23). Yapılan bir çalışmada(3), FIP teşhisi konulan kedilerin %56,7'sinde daha önce strese neden olan spesifik olaylar saptanmıştır. FIP ayırt edici tanı listesinde yer alıyorsa, yakın zamanda yaşanan stres faktörleri de dahil olmak üzere ayrıntılı bir vaka öyküsü anketiyle risk faktörlerini değerlendirmek, tanı çalışmasında oldukça önemli bir başlangıç noktasıdır. Bu sürece yardımcı olabilecek hastalık öyküsü anketi ek dosya 9 bölümünde sunulmuştur.
❖ Retrovirüsler: Retroviral enfeksiyonlar FIP için bir risk faktörü olabilir. Yapılan bir çalışmada kedi immün yetmezlik virüsü (FIV) enfeksiyonu ile yüksek FIP riski arasında bir bağlantı olduğu kaydedilmiştir(22).
1970/1980'lerde kedi lösemi virüsü (FeLV) aşısının ortaya çıkmasından önce, FIP'li kedilerin %30 ila %50'sinde eş zamanlı FeLV enfeksiyonu da görülmüştür(72,86).
Bir kedinin FIP'e yatkınlığı, virüs virülans faktörleri, konakçı faktörleri (örneğin genetik özellikler, yaş), FCoV enfeksiyonu sırasında eşzamanlı görülen hastalıklar ve/veya diğer stres faktörleri arasındaki karşılıklı etkiyle belirlenir.
Klasik tabloya uymayan vakalarda (örneğin, tek kedili bir evde yaşayan yaşlı bir kedi) ayırt edici tanı listesinde FIP yer almayabilir. Eşzamanlı hastalık mevcut olduğunda FIP'in gizli belirtileri de gözden kaçabilir.
Veteriner hekimlikte bir kedinin FIP hastası olduğuna dair kesin tanı koyma veya ölüm öncesinde şüphe indeksini yükseltme becerisi birçok çalışmanın odak noktası olmuştur(28,50,78,80,82-86). FIP tanısına ulaşmak için veteriner hekim, şüphe indeksini "adım adım" yükseltmek amacıyla hastanın öyküsünü, belirtilerini ve fizik muayene bulgularını göz önünde bulundurmalı ve tanısal testler ile numune tiplerini buna göre seçmelidir (Şekil 1). FIP tanısı koymaya çalışırken, kan (tam kan, serum, plazma, periferik kan mononükleer hücreleri [PBMC]), effüzyonlar (torasik, abdominal, perikardiyal), dokular, beyin omurilik sıvısı (CSF), aköz hümör ve/veya doku ince iğne aspiratları (FNA) ve biyopsiler dahil olmak üzere çeşitli örnek türleri üzerinde benzer veya farklı test yöntemleri kullanılabilir.
Belirtiler ve Hastanın Öyküsü
FIP'in patogenezi oldukça karmaşıktır ve bir kedide FIP'e yatkınlık virüse ait virülans faktörleri, genetik özellikler gibi konak faktörleri, FCoV'ye maruz kalındığı sırada kedinin yaşı, genç bir kedinin FCoV enfeksiyonuyla mücadele ettiği sırada eş zamanlı görülen hastalıklar ve/veya diğer stres faktörleri arasındaki karşılıklı etkileşimi kapsamaktadır(86-88).
Konak faktörleri, majör histokompatibilite kompleksi (MHC) çeşitliliği, sitokin üretimi ve lenfosit apoptozu dahil olmak üzere kedinin bağışıklık sistemi durumunu etkileyebilir. Örneğin, MHC II'nin bazı özellikleri bağışıklık sisteminin verdiği tepkinin kalitesini etkileyebilir(73,89). Ayrıca, sitokin ve reseptör bağlantılı tek nükleotid polimorfizmleri ile FIP'e karşı artan duyarlılık arasında bir bağlantı olduğu öne sürülmektedir(62).
FIP oluşumu için kedinin belirtileri ve öyküsüyle ilgili bir dizi risk faktörü belirlenmiştir (Tablo 1'de listelenmiş ve aşağıda özetlenmiştir).
❖ Toplu yaşam alanı: Birden fazla kedinin bulunduğu ortamlarda, FCoV enfeksiyonlu kedilerin yaklaşık %12'sinde FIP ortaya çıkacaktır(90,91) ve virüsün birden fazla kedinin bulunduğu ortamlardan kaynaklanması önemli bir risk faktörüdür. Bununla birlikte, yapılan bir çalışmada(3), FIP teşhisi konulan kedilerin neredeyse üçte ikisi teşhis sırasında tek veya iki kedili evlerde yaşamaktaydı (bunun nedenlerinden biri, yeni bir eve katılmadan ve FIP oluşmadan önce FCoV'ye maruz kalmış ve uzun süre bu virüsü taşımış olmalarıdır).
❖ Yaş: FIP, ağırlıklı olarak 2 yaşın altındaki kedileri etkilemektedir(3-5,66-69). Avustralya(66) ve Kuzey Carolina, ABD'de(4) yapılan çalışmalarda, FIP'li kedilerin sırasıyla %55 ve %67'sinin 2 yaşından küçük olduğu rapor edilmiştir.
❖ Cinsiyet ve kısırlaştırma durumu: Yapılan bazı çalışmalarda erkek kedilerin FIP'e yatkın olduğu bulunmuştur(3,5,14,66,68).
Ayrıca, çeşitli çalışmalarda da kısır olmayan kedilerde, özellikle de erkeklerde bu riskin arttığı belirtilmiştir(4,5,92).
❖ Irk: FIP'li kediler arasında çok sayıda safkan kedi bulunmaktadır ve safkan kedilerde hastalığa karşı kalıtsal bir duyarlılık olduğu tartışılmaktadır(93). Kuzey Carolina'da yapılan çalışmada(4), safkan kedilerin yaklaşık %1,3'ünde FIP görülürken, melez kedilerde bu oran %0,35'tir; Avustralya'daki çalışmada ise FIP'li kedilerin %71'i safkandır(66). FIP, bazı kedi familyalarını etkileyebilmektedir(73) ve bulgular çalışmalar arasında farklılık gösterse de (bkz. ek dosya 7), belirli ırklar bu hastalığa daha fazla/daha az yatkın veya hastalık bu ırklarda daha fazla/daha az oranda görülmektedir (3,68).
❖ Stres: Stresin FIP riskini artırdığı da öne sürülmüştür(23). Yapılan bir çalışmada(3), FIP teşhisi konulan kedilerin %56,7'sinde daha önce strese neden olan spesifik olaylar saptanmıştır. FIP ayırt edici tanı listesinde yer alıyorsa, yakın zamanda yaşanan stres faktörleri de dahil olmak üzere ayrıntılı bir vaka öyküsü anketiyle risk faktörlerini değerlendirmek, tanı çalışmasında oldukça önemli bir başlangıç noktasıdır. Bu sürece yardımcı olabilecek hastalık öyküsü anketi ek dosya 9 bölümünde sunulmuştur.
❖ Retrovirüsler: Retroviral enfeksiyonlar FIP için bir risk faktörü olabilir. Yapılan bir çalışmada kedi immün yetmezlik virüsü (FIV) enfeksiyonu ile yüksek FIP riski arasında bir bağlantı olduğu kaydedilmiştir(22).
1970/1980'lerde kedi lösemi virüsü (FeLV) aşısının ortaya çıkmasından önce, FIP'li kedilerin %30 ila %50'sinde eş zamanlı FeLV enfeksiyonu da görülmüştür(72,86).
Bir kedinin FIP'e yatkınlığı, virüs virülans faktörleri, konakçı faktörleri (örneğin genetik özellikler, yaş), FCoV enfeksiyonu sırasında eşzamanlı görülen hastalıklar ve/veya diğer stres faktörleri arasındaki karşılıklı etkiyle belirlenir.Fizik Muayene Bulguları
FIP'li kedilerde genellikle iştahsızlık, letarji, artan/azalan ateş (genellikle antibiyotiklere yanıt vermez), lenfadenopati ve kilo kaybı görülür. Yavru kedilerde ise kilo alamama sorunu ortaya çıkar (Tablo 2)(3,86,88,94). Bunlar, spesifik olmayan klinik belirtilerdir. Bu belirtiler effüzyon olup olmadığına bakılmaksızın ortaya çıkabilir ve hasta sahipleri tarafından bildirilebilir ya da özellikle hastalığın erken evrelerinde muayene sırasında fark edilebilir(3,88,94).
 Sitolojik analiz yapmak amacıyla örnek alınabilecek küçük abdominal veya torasik effüzyon boşluklarını tespit etmek için tekrar tekrar ultrason muayeneleri yapılmalıdır.
Sitolojik analiz yapmak amacıyla örnek alınabilecek küçük abdominal veya torasik effüzyon boşluklarını tespit etmek için tekrar tekrar ultrason muayeneleri yapılmalıdır.
'Islak' ve 'kuru' FIP arasında ayrım yapmak pek de anlamlı değildir çünkü bunlar iki farklı hastalık türü değildir. FIP'in 'efüzif' (parankimatöz olmayan) ve 'efüzif olmayan' (parankimatöz) formları (daha önce kullanılan terimler) arasında ayrım yapmak teşhis açısından önemli olsa da, ilk başta efüzif olmayan FIP ile kliniğe getirilen kedilerde genellikle ilerleyen dönemlerde effüzyon görülür(28,46,48). Ayrıca, effüzyonlu FIP ile kliniğe getirilen kedilerin nekropsisinde piyogranülomatöz lezyonlara da rastlanmaktadır(28). Effüzyon söz konusu olduğunda FIP'in teşhisi daha kolay olduğundan, sitolojik analiz için örnek alınabilecek küçük abdominal veya torasik effüzyon boşlukları tespit etmek için tekrar tekrar ultrason muayeneleri yapılmalıdır (daha sonra bakınız)
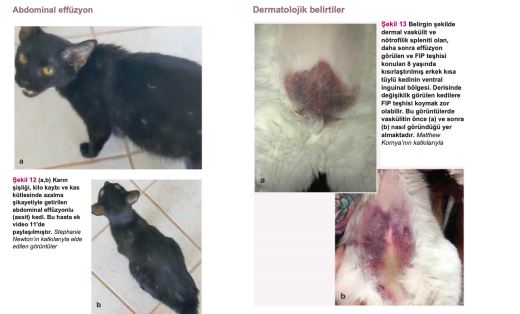
FIP'in klinik seyri çok değişken olduğundan (bkz. 911-912. sayfalardaki 'FIP'in birçok yüzü' bölümündeki Şekil 2-13), kapsamlı bir fizik muayene şarttır (Şekil 14). Sağlıklı bir yavru kedide görülen hafif ateş, hastalığın ilk ipucu olabilir. Bu nedenle, yavru kedi muayeneleri sırasında kedi dostu yöntemlerle (örneğin kulak termometresi; Şekil 14a) yavru kedilerin ateşi ölçülmelidir.
FIP çoğunlukla vasküler geçirgenliğin artmasına, damar sıvısı kaçağına ve proteinden yana zengin effüzyonların oluşumuna yol açmaktadır(3,67,84). Effüzyon, FIP'li kedilerde görülen en tipik değişikliktir(3,88,92). FIP olduğu doğrulanmış 224 kedi üzerinde yapılan bir çalışmada, kedilerin %78'inde effüzyon görülmüştür(3). FIP olduğundan şüphelenilen 127 kedi üzerinde yapılan başka bir çalışmada, 92/109'unda asit ve 11/109'unda plevral effüzyon olmak üzere kedilerin %86'sında effüzyon görülmüştür(92). Aynı şekilde FIP, effüzyonla prezente olan kedilerde en sık görülen hastalıklardan biridir. Effüzyonlu 197 kedinin dahil edildiği bir çalışmada, vakaların %41'inde FIP görülmüştür(96). Bir üniversite hastanesinde etiyolojisi belirlenen ve plevral effüzyon tanısı konan 306 kedinin yer aldığı yakın tarihli retrospektif bir çalışmada ise kedilerin yalnızca %9'unda FIP görülmüştür(97).
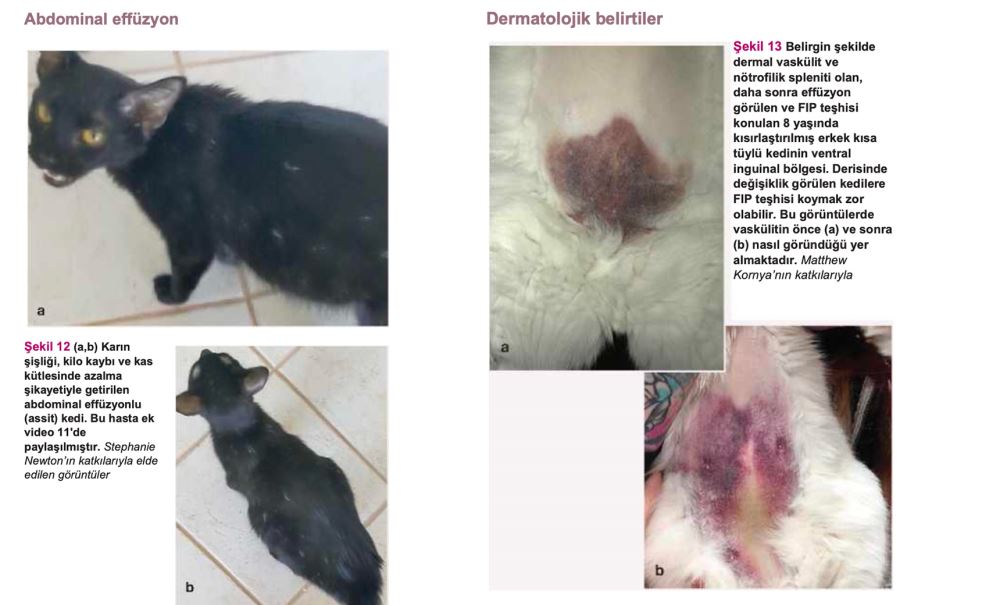
Effüzyon farklı şekillerde ortaya çıkabilir. Bunlar; assit (en yaygın olandır, genellikle abdominal distansiyonla birlikte meydana gelir; Şekil 12), plevral effüzyon (dispne, takipne ve boğuk kalp sesleri şeklinde görülebilir), perikardiyal effüzyon veya nadiren skrotal effüzyondur(3,28). Plevral effüzyonlarla ilgili yapılan bir çalışmada, yavru ve genç kedilerde görülen en yaygın iki nedenin FIP ve travma olduğu tespit edilmiştir(98).
FIP piyogranülomatöz lezyonlara ve kitlelere neden olabilir. Klinik belirtiler hastalığın hangi organ(lar)ı etkilediğine bağlıdır; en çok böbrekler, karaciğer, bağırsaklar (lokal lenf düğümleri dahil), beyin ve gözler etkilenmektedir(46,66,88,99).
FIP'in Değişik Şekillerdeki Görünümü






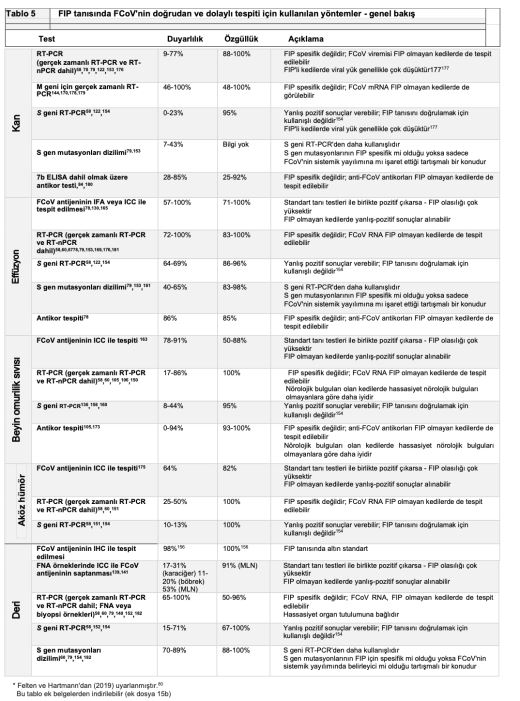
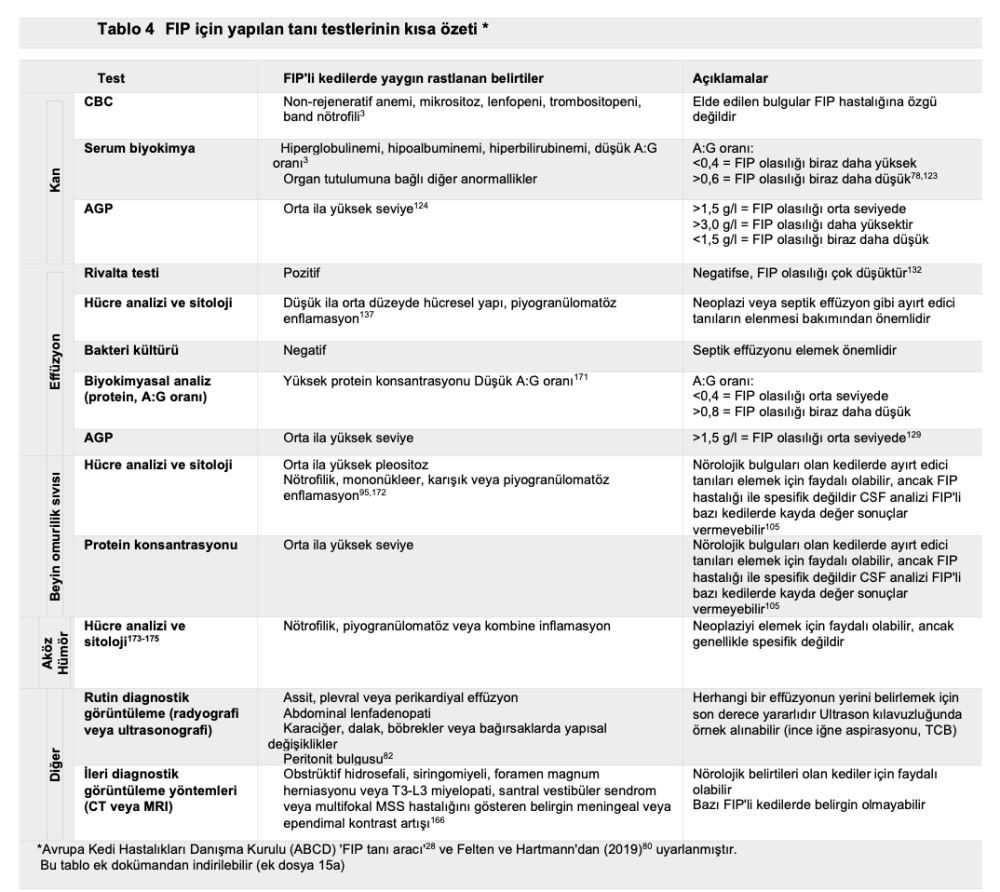
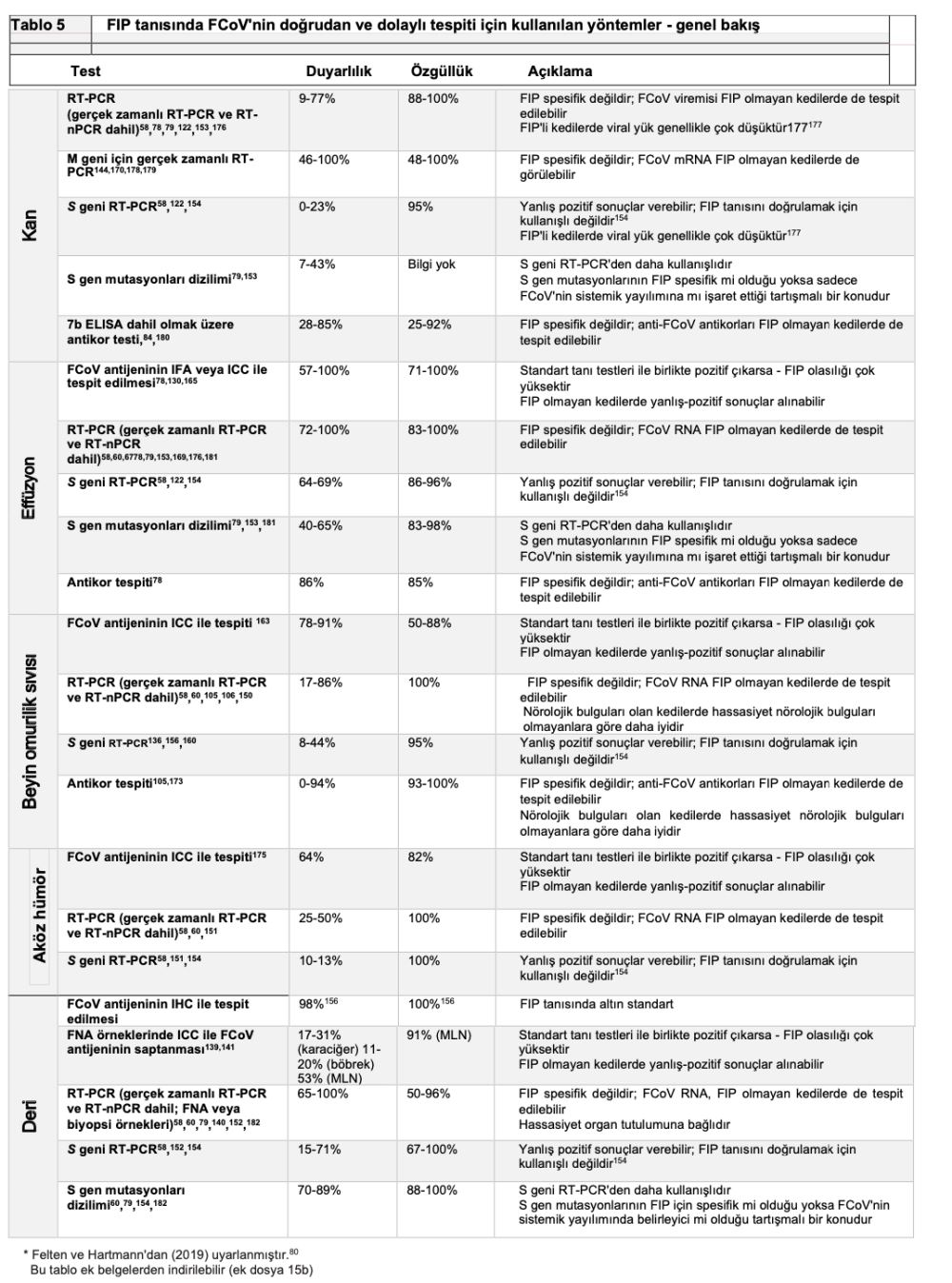
 FIP ayırt edici bir tanı ise, tam kan sayımı, serum biyokimyası, idrar tahlili ve FeLV/FIV testi gibi temel laboratuvar analizleri yapılır. Patognomonik olmamakla birlikte, birçok FIP'li kedide hafif non-rejeneratif anemi, lenfopeni, hiperbilirubinemi, hiperglobulinemi(3,83) ve albümin/globulin oranı (A:G) <0,4,3,67,123 ve yüksek serum amiloid A ve alfa-1-asit glikoprotein (AGP) konsantrasyonları görülebilir(79,124). Etkilenen organın sistemine bağlı olarak diğer klinikopatolojik anormallikler de görülebilir (tanı testlerinin özeti için Tablo 4 ve 5'e bakınız).
Effüzyon Analizi
Farklı test yöntemlerinin kullanıldığı çeşitli çalışmalarda tanısal doğruluğun en yüksek olduğu yöntemin effüzyon analizi olduğu tespit edilmiştir, bu nedenle sıvı eğer mümkünse mutlaka analiz edilmelidir (aşağıdaki ipuçları kutusuna bakınız). Açıkça veya görüntüleme yoluyla effüzyona dair herhangi bir kanıt bulunmazsa, FIP ante-mortem tanısı koymak çok daha zor hale gelecektir(78,80).
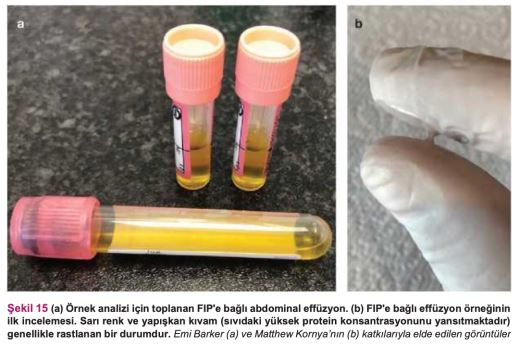
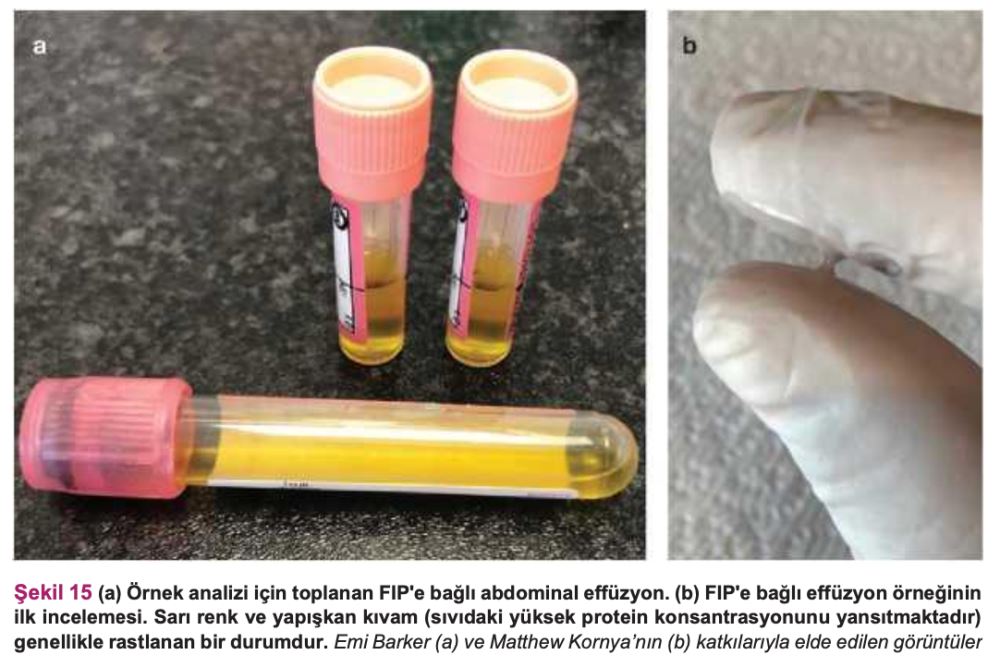
Ancak bazı FIP vakalarında, effüzyon olsa bile tanı koymak yine de zor olabilir. FIP'in neden olduğu effüzyon tipik olarak sarı ve yapışkan kıvamda olsa da (Şekil 15), bazı kedilerde daha pembe tonda veya sulu/yapışkan olmayan effüzyonlar görülür.
Ayrıca, effüzyonlar beklenmedik şekilde ortaya çıkabilir. Örneğin, kısırlaştırılmamış erkek kedilerde testislerin tunika vajinalisini etkileyen serozit nedeniyle yalnızca skrotal effüzyon ve büyüme görülebilir(127). Perikardiyal effüzyonlar bazen diğer vücut boşluklarında effüzyon olmaksızın ortaya çıkabilir(70,128).
Genellikle, FIP effüzyonlarında protein konsantrasyonu yüksek ve beyaz kan hücresi sayısı düşüktür. Bu nedenle, toplam protein konsantrasyonuna ve toplam hücre sayısına bağlı olmak üzere, yapılacak sınıflandırma modifiye transüda veya eksüda şeklinde değişiklik gösterebilir(28). Ancak, bazı FIP'li kedilerde effüzyondaki hücre sayısı çok yüksek olabilir (örneğin, sekonder bakteriyel peritonit). FIP'li kedilerde zaman zaman kilüslü effüzyonlar bile rapor edilmiştir(71). Effüzyonlar bazen havayla temas ettiğinde pıhtılaşır. Su buharında hafifçe ısıtmak, detaylı analiz amacıyla sıvı elde etmek için pıhtının çözülmesine yardımcı olabilir.
FIP ayırt edici bir tanı ise, tam kan sayımı, serum biyokimyası, idrar tahlili ve FeLV/FIV testi gibi temel laboratuvar analizleri yapılır. Patognomonik olmamakla birlikte, birçok FIP'li kedide hafif non-rejeneratif anemi, lenfopeni, hiperbilirubinemi, hiperglobulinemi(3,83) ve albümin/globulin oranı (A:G) <0,4,3,67,123 ve yüksek serum amiloid A ve alfa-1-asit glikoprotein (AGP) konsantrasyonları görülebilir(79,124). Etkilenen organın sistemine bağlı olarak diğer klinikopatolojik anormallikler de görülebilir (tanı testlerinin özeti için Tablo 4 ve 5'e bakınız).
Effüzyon Analizi
Farklı test yöntemlerinin kullanıldığı çeşitli çalışmalarda tanısal doğruluğun en yüksek olduğu yöntemin effüzyon analizi olduğu tespit edilmiştir, bu nedenle sıvı eğer mümkünse mutlaka analiz edilmelidir (aşağıdaki ipuçları kutusuna bakınız). Açıkça veya görüntüleme yoluyla effüzyona dair herhangi bir kanıt bulunmazsa, FIP ante-mortem tanısı koymak çok daha zor hale gelecektir(78,80).
Ancak bazı FIP vakalarında, effüzyon olsa bile tanı koymak yine de zor olabilir. FIP'in neden olduğu effüzyon tipik olarak sarı ve yapışkan kıvamda olsa da (Şekil 15), bazı kedilerde daha pembe tonda veya sulu/yapışkan olmayan effüzyonlar görülür.
Ayrıca, effüzyonlar beklenmedik şekilde ortaya çıkabilir. Örneğin, kısırlaştırılmamış erkek kedilerde testislerin tunika vajinalisini etkileyen serozit nedeniyle yalnızca skrotal effüzyon ve büyüme görülebilir(127). Perikardiyal effüzyonlar bazen diğer vücut boşluklarında effüzyon olmaksızın ortaya çıkabilir(70,128).
Genellikle, FIP effüzyonlarında protein konsantrasyonu yüksek ve beyaz kan hücresi sayısı düşüktür. Bu nedenle, toplam protein konsantrasyonuna ve toplam hücre sayısına bağlı olmak üzere, yapılacak sınıflandırma modifiye transüda veya eksüda şeklinde değişiklik gösterebilir(28). Ancak, bazı FIP'li kedilerde effüzyondaki hücre sayısı çok yüksek olabilir (örneğin, sekonder bakteriyel peritonit). FIP'li kedilerde zaman zaman kilüslü effüzyonlar bile rapor edilmiştir(71). Effüzyonlar bazen havayla temas ettiğinde pıhtılaşır. Su buharında hafifçe ısıtmak, detaylı analiz amacıyla sıvı elde etmek için pıhtının çözülmesine yardımcı olabilir.
 Unutulmaması gereken önemli bilgiler:
Effüzyonlu bir hastanın tanı amaçlı sitoloji lamları nasıl hazırlanır?
❖ Bir etilen diamin tetra asetik asit (EDTA) tüpüne yeterli miktarda numune koyun. Daima yeni ve temiz mikroskop lamları kullanın.
❖ Her bir boya düzeneğini üretici firmanın talimatlarına uygun bir şekilde düzenli aralıklarla değiştirin.
❖ Lamı ısıyla sabitlemeyin, fakat boyamadan önce numunenin tamamen kurumasını bekleyin.
Effüzyonun rengini/bulanıklığını inceleyin:
❖ Bulanıklığı az ve berraksa, sıvıyı 165-360 g'de 5 dakika santrifüjleyerek numunenin konsantre bir hale getirilmesi gerekecektir. Bunun için, radyal kol uzunluğu 14,6 cm olan bir santrifüjde sıvının dakikada 1000-1500 devirde (rpm) santrifüj edilmesi önerilir. Santrifüjden sonra, süpernatantın çoğu dökülür ve tüpün dibinde pelet ile birlikte sadece yaklaşık 0,5 ml sıvı kalır. Pelet daha sonra kalan 0,5 ml sıvı içinde hafifçe çalkalanarak yeniden süspanse edilir, süspansiyondan bir damla lam üzerine yerleştirilir ve ardından çekerek yayma (pull smear) veya ezme (squash) işlemi ile preparat hazırlanır.
Bu bölümdeki bilgiler kaynakçadaki 125 ve 126 numaralı referansa göre hazırlanmıştır.
❖ Eğer sıvı bulanıksa, bir damla sıvıyı lam üzerine koyduktan sonra çekerek yayma ile ya da ezerek preparat hazırlama tekniklerinden biriyle santrifüjleme yapmadan direkt yayma işlemi yapılabilir.
Lamı boyayın:
❖ Diff-Quik gibi Romanowsky tipi bir boya kullanın.
❖ Boyama işlemlerini yaparken üretici firmanın talimatlarını uygulayın. Lamlar daldırıldığında boyama işleminin (lamların pasif bir şekilde batırılmasına kıyasla) daha iyi sonuç verdiği gözlemlenmiştir.
❖ Boyamadan sonra lamı 20 saniye boyunca oda sıcaklığında suyla durulayın.
❖ Lamı dikey bir şekilde yerleştirin ve kurumaya bırakın.
❖ Değerlendirme yapabilmek için iyi korunmuş yeterli sayıda hücre olup olmadığını,
❖ Numunedeki, standart morfoloji ve boyama niteliklerine sahip hücreleri (örneğin, çoğu numunede bulunabilen nötrofil türü periferik kan hücresi) belirleyerek uygun şekilde boyanıp boyanmadığını kontrol etmek için mikroskop (x 10 veya x 20 mercek) kullanarak lamı inceleyin.
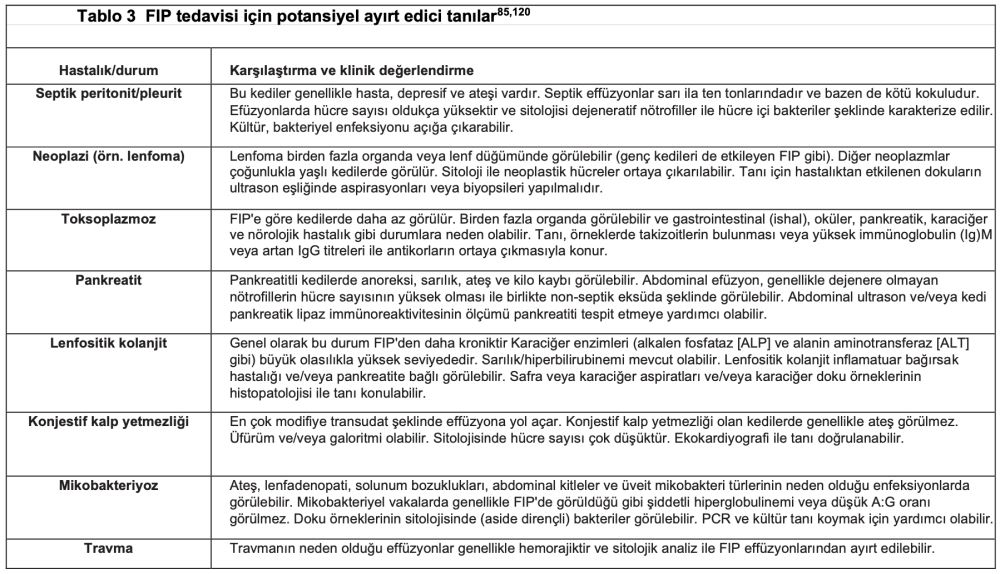
FIP ve Ortak Farklılıkları Olan Kedilerde Effüzyon ve Doku Örneklerinin Sitolojisi
Unutulmaması gereken önemli bilgiler:
Effüzyonlu bir hastanın tanı amaçlı sitoloji lamları nasıl hazırlanır?
❖ Bir etilen diamin tetra asetik asit (EDTA) tüpüne yeterli miktarda numune koyun. Daima yeni ve temiz mikroskop lamları kullanın.
❖ Her bir boya düzeneğini üretici firmanın talimatlarına uygun bir şekilde düzenli aralıklarla değiştirin.
❖ Lamı ısıyla sabitlemeyin, fakat boyamadan önce numunenin tamamen kurumasını bekleyin.
Effüzyonun rengini/bulanıklığını inceleyin:
❖ Bulanıklığı az ve berraksa, sıvıyı 165-360 g'de 5 dakika santrifüjleyerek numunenin konsantre bir hale getirilmesi gerekecektir. Bunun için, radyal kol uzunluğu 14,6 cm olan bir santrifüjde sıvının dakikada 1000-1500 devirde (rpm) santrifüj edilmesi önerilir. Santrifüjden sonra, süpernatantın çoğu dökülür ve tüpün dibinde pelet ile birlikte sadece yaklaşık 0,5 ml sıvı kalır. Pelet daha sonra kalan 0,5 ml sıvı içinde hafifçe çalkalanarak yeniden süspanse edilir, süspansiyondan bir damla lam üzerine yerleştirilir ve ardından çekerek yayma (pull smear) veya ezme (squash) işlemi ile preparat hazırlanır.
Bu bölümdeki bilgiler kaynakçadaki 125 ve 126 numaralı referansa göre hazırlanmıştır.
❖ Eğer sıvı bulanıksa, bir damla sıvıyı lam üzerine koyduktan sonra çekerek yayma ile ya da ezerek preparat hazırlama tekniklerinden biriyle santrifüjleme yapmadan direkt yayma işlemi yapılabilir.
Lamı boyayın:
❖ Diff-Quik gibi Romanowsky tipi bir boya kullanın.
❖ Boyama işlemlerini yaparken üretici firmanın talimatlarını uygulayın. Lamlar daldırıldığında boyama işleminin (lamların pasif bir şekilde batırılmasına kıyasla) daha iyi sonuç verdiği gözlemlenmiştir.
❖ Boyamadan sonra lamı 20 saniye boyunca oda sıcaklığında suyla durulayın.
❖ Lamı dikey bir şekilde yerleştirin ve kurumaya bırakın.
❖ Değerlendirme yapabilmek için iyi korunmuş yeterli sayıda hücre olup olmadığını,
❖ Numunedeki, standart morfoloji ve boyama niteliklerine sahip hücreleri (örneğin, çoğu numunede bulunabilen nötrofil türü periferik kan hücresi) belirleyerek uygun şekilde boyanıp boyanmadığını kontrol etmek için mikroskop (x 10 veya x 20 mercek) kullanarak lamı inceleyin.
FIP ve Ortak Farklılıkları Olan Kedilerde Effüzyon ve Doku Örneklerinin Sitolojisi
 Laboratuvar analizi genellikle protein içeriğinin >35 g/l,9 A:G oranının <0,4 ve hücre sayısının <5 x 109 hücre/l olduğunu gösterecektir. Toplam protein ve albümin düzenli aralıklarla ölçülüyorsa ve globülin konsantrasyonu (toplam protein eksi toplam albümin) ve A:G oranı hesaplanıyorsa, effüzyon protein elektroforezi çok da fazla değer katmayacaktır.
Yapılan bir çalışmada AGP seviyesinin FIP effüzyonlarında yüksek olduğu (>1550 ^g/ml) ve %93'lük bir duyarlılık ve özgüllüğe sahip olduğu bildirilmiştir, ancak FIP tanısı her zaman immün boyama veya histopatoloji ile doğrulanmamaktadır(129). FCoV'un hücre peletinin immünositokimyasının (ICC) duyarlılığı nispeten daha yüksektir, ancak özgüllüğü orta düzeydedir ve yanlış pozitif sonuçlar ortaya çıkabilir.130 ('Viral antijenin tespit edilmesi' ile ilgili bölüme bakınız).
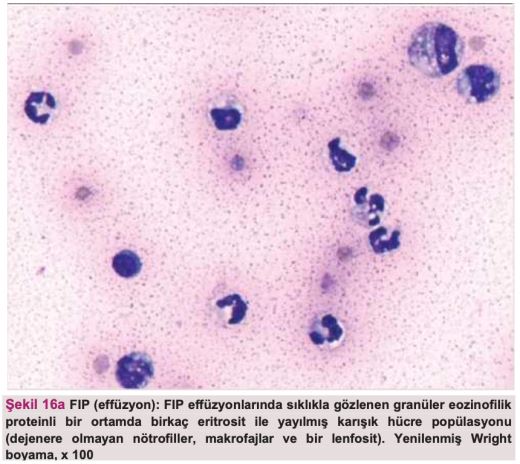
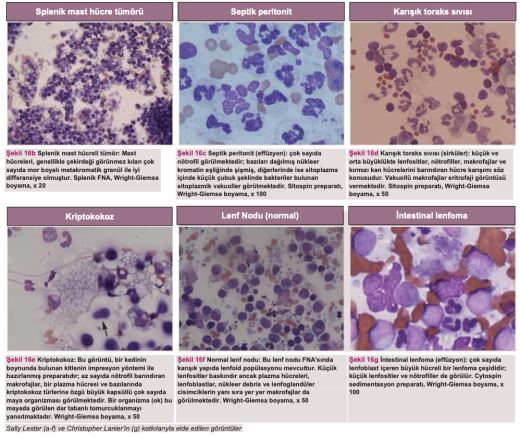
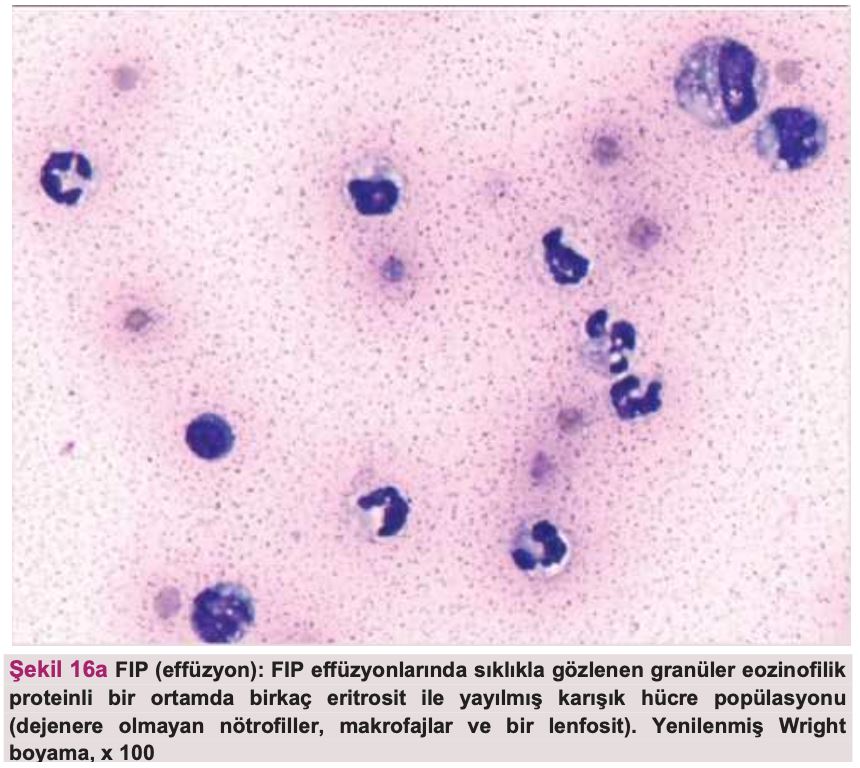
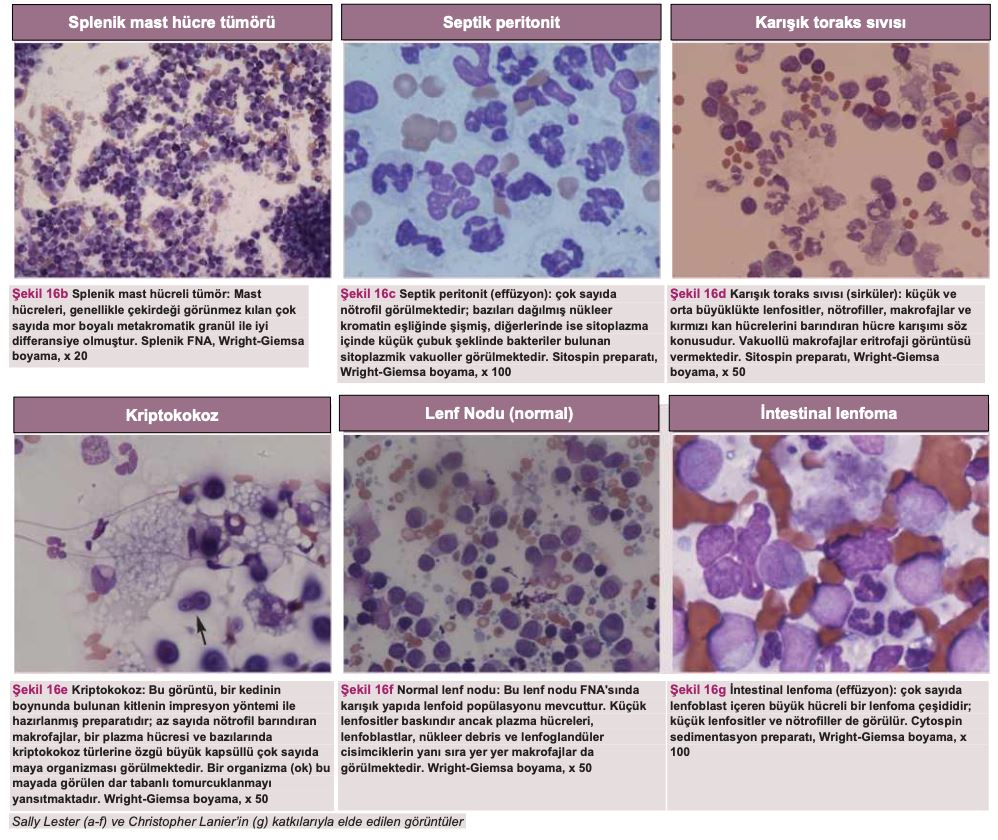
Sitoloji ve bakteri kültürü, FIP'in effüzyona yol açan diğer nedenlerden ayırt edilmesinde oldukça önemlidir. Şekil 16'da effüzyonlardan ve dokulardan elde edilen sitoloji örnekleri gösterilmekte ve bu tanı tekniğinin önemi vurgulanmaktadır. Genel olarak, FIP effüzyonlarının sitolojisi makrofajlar, dejenere olmayan nötrofiller ve az sayıda lenfosit içeren piyogranülomatöz inflamasyonu ortaya koymaktadır(80). Bu durum, örneğin sitolojik örnekte bulunan ve bakteriyel peritonit/pleurite işaret eden nötrofili, toksik nötrofiller ve hücre içi bakterilerle veya lenfomaya işaret eden belirgin nükleollü büyük lenfoblastlar gibi neoplastik hücrelerle kontrast oluşturmaktadır. Sayfa 915'teki bölümde tanı amaçlı sitoloji lamlarının yerinde hazırlanması için faydalı ipuçları yer almaktadır.
Rivalta testi, effüzyonları incelemek için basit, hızlı ve ucuz bir tanı yöntemidir(78,131). Özellikle barınak koşulları gibi maddi zorlukların söz konusu olduğu durumlarda FIP'i elemek için kullanılan oldukça faydalı bir yöntemdir. Test, hafif asetik bir solüsyona bir damla effüzyon damlatılarak yapılır ( faydalı ipuçları bölümüne bakınız). Yüksek protein oranı ve enflamatuar mediyatörlerin mevcut olması - bunlar, FIP'in neden olduğu efüzyonların özellikleridir - damlanın çökelmesine neden olarak test sonucunu pozitif çıkaracaktır (Şekil 17). Damla dağılırsa, test sonucu negatif olarak kabul edilir. Effüzyonun 3 haftaya kadar saklanması test sonuçlarında herhangi bir fark yaratmaz. Fakat test sonuçlarının yorumlanması öznellik açısından zor olabilir zira yapılacak değerlendirme hekimin tecrübesine bağlıdır(131).
Unutulmaması gereken önemli bilgiler:
Rivalta testi nasıl yapılır?
❖ Oda sıcaklığında 8 ml damıtılmış su ve 20 pl (1 damla) %100 asetik asidi plastik deney tüpünde (hacim 10 ml) karıştırın.
❖ Bu çözeltinin yüzeyine 20 pl (1 damla) efüzyonu dikkatlice tabaka halinde koyun.
❖ Damlanın nasıl tepki verdiğini gözlemleyin:
- Pozitif test sonucu damlanın çökelmesi ve çözeltinin yüzeyinde kalması, yüzeye tutunarak şeklini koruması veya bir damla ya da
denizanası gibi yavaşça tüpün dibine doğru süzülmesi ile anlaşılır.
- Negatif test sonucu damlanın dağılması (kaybolması) ve çözeltinin berrak halde durması ile anlaşılır.
Laboratuvar analizi genellikle protein içeriğinin >35 g/l,9 A:G oranının <0,4 ve hücre sayısının <5 x 109 hücre/l olduğunu gösterecektir. Toplam protein ve albümin düzenli aralıklarla ölçülüyorsa ve globülin konsantrasyonu (toplam protein eksi toplam albümin) ve A:G oranı hesaplanıyorsa, effüzyon protein elektroforezi çok da fazla değer katmayacaktır.
Yapılan bir çalışmada AGP seviyesinin FIP effüzyonlarında yüksek olduğu (>1550 ^g/ml) ve %93'lük bir duyarlılık ve özgüllüğe sahip olduğu bildirilmiştir, ancak FIP tanısı her zaman immün boyama veya histopatoloji ile doğrulanmamaktadır(129). FCoV'un hücre peletinin immünositokimyasının (ICC) duyarlılığı nispeten daha yüksektir, ancak özgüllüğü orta düzeydedir ve yanlış pozitif sonuçlar ortaya çıkabilir.130 ('Viral antijenin tespit edilmesi' ile ilgili bölüme bakınız).
Sitoloji ve bakteri kültürü, FIP'in effüzyona yol açan diğer nedenlerden ayırt edilmesinde oldukça önemlidir. Şekil 16'da effüzyonlardan ve dokulardan elde edilen sitoloji örnekleri gösterilmekte ve bu tanı tekniğinin önemi vurgulanmaktadır. Genel olarak, FIP effüzyonlarının sitolojisi makrofajlar, dejenere olmayan nötrofiller ve az sayıda lenfosit içeren piyogranülomatöz inflamasyonu ortaya koymaktadır(80). Bu durum, örneğin sitolojik örnekte bulunan ve bakteriyel peritonit/pleurite işaret eden nötrofili, toksik nötrofiller ve hücre içi bakterilerle veya lenfomaya işaret eden belirgin nükleollü büyük lenfoblastlar gibi neoplastik hücrelerle kontrast oluşturmaktadır. Sayfa 915'teki bölümde tanı amaçlı sitoloji lamlarının yerinde hazırlanması için faydalı ipuçları yer almaktadır.
Rivalta testi, effüzyonları incelemek için basit, hızlı ve ucuz bir tanı yöntemidir(78,131). Özellikle barınak koşulları gibi maddi zorlukların söz konusu olduğu durumlarda FIP'i elemek için kullanılan oldukça faydalı bir yöntemdir. Test, hafif asetik bir solüsyona bir damla effüzyon damlatılarak yapılır ( faydalı ipuçları bölümüne bakınız). Yüksek protein oranı ve enflamatuar mediyatörlerin mevcut olması - bunlar, FIP'in neden olduğu efüzyonların özellikleridir - damlanın çökelmesine neden olarak test sonucunu pozitif çıkaracaktır (Şekil 17). Damla dağılırsa, test sonucu negatif olarak kabul edilir. Effüzyonun 3 haftaya kadar saklanması test sonuçlarında herhangi bir fark yaratmaz. Fakat test sonuçlarının yorumlanması öznellik açısından zor olabilir zira yapılacak değerlendirme hekimin tecrübesine bağlıdır(131).
Unutulmaması gereken önemli bilgiler:
Rivalta testi nasıl yapılır?
❖ Oda sıcaklığında 8 ml damıtılmış su ve 20 pl (1 damla) %100 asetik asidi plastik deney tüpünde (hacim 10 ml) karıştırın.
❖ Bu çözeltinin yüzeyine 20 pl (1 damla) efüzyonu dikkatlice tabaka halinde koyun.
❖ Damlanın nasıl tepki verdiğini gözlemleyin:
- Pozitif test sonucu damlanın çökelmesi ve çözeltinin yüzeyinde kalması, yüzeye tutunarak şeklini koruması veya bir damla ya da
denizanası gibi yavaşça tüpün dibine doğru süzülmesi ile anlaşılır.
- Negatif test sonucu damlanın dağılması (kaybolması) ve çözeltinin berrak halde durması ile anlaşılır.
 Daha önce yapılan çalışmalarda, Rivalta testi FIP tanısında yüksek duyarlılık ve özgüllük ortaya koymuştur(78,96). Bununla birlikte, 851 kediden oluşan geniş kapsamlı bir çalışmada, NPV hala yüksek olmasına ve PPV'nin 2 yaşından küçük kedilerde neredeyse %90'a ulaşmasına rağmen, duyarlılık ve özgüllük daha düşüktü (sırasıyla %91 ve %66)(132). Bu durum, Rivalta testinin negatif çıkması halinde FIP olasılığının da çok düşük olduğu anlamına gelmektedir. Rivalta testinin pozitif çıkması, özellikle genç kedilerde FIP şüphesini artırmaktadır; ancak pozitif sonuçlar bakteriyel peritonit/pleurit veya lenfomalı kedilerde de görülebileceğinden, bu durum diğer testlerle birlikte teyit edilmelidir(132). Sıvı sitolojisi ve bakteri kültürü bu vakalar arasında ayrım yapılmasına yardımcı olabilir(133).
Tanısal Görüntüleme
Daha önce yapılan çalışmalarda, Rivalta testi FIP tanısında yüksek duyarlılık ve özgüllük ortaya koymuştur(78,96). Bununla birlikte, 851 kediden oluşan geniş kapsamlı bir çalışmada, NPV hala yüksek olmasına ve PPV'nin 2 yaşından küçük kedilerde neredeyse %90'a ulaşmasına rağmen, duyarlılık ve özgüllük daha düşüktü (sırasıyla %91 ve %66)(132). Bu durum, Rivalta testinin negatif çıkması halinde FIP olasılığının da çok düşük olduğu anlamına gelmektedir. Rivalta testinin pozitif çıkması, özellikle genç kedilerde FIP şüphesini artırmaktadır; ancak pozitif sonuçlar bakteriyel peritonit/pleurit veya lenfomalı kedilerde de görülebileceğinden, bu durum diğer testlerle birlikte teyit edilmelidir(132). Sıvı sitolojisi ve bakteri kültürü bu vakalar arasında ayrım yapılmasına yardımcı olabilir(133).
Tanısal Görüntüleme
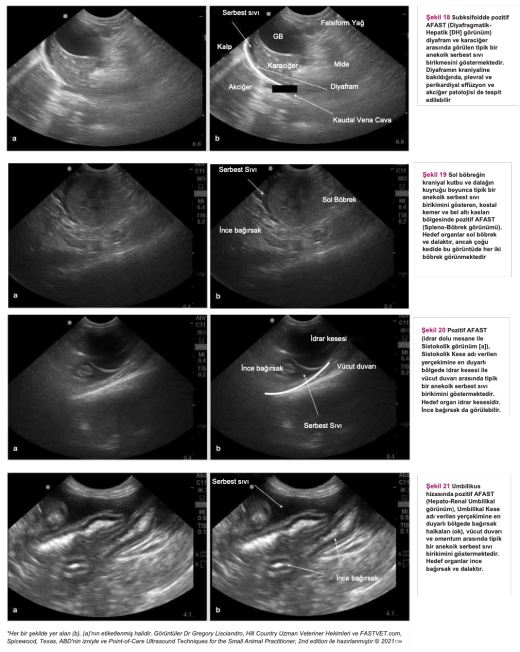
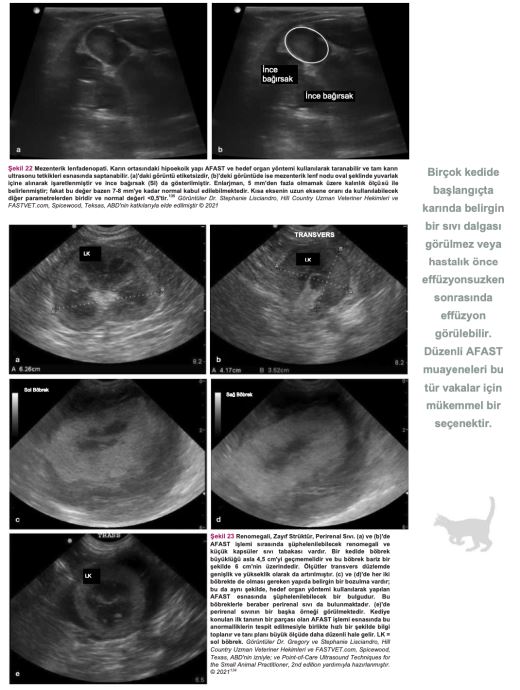
Travmada abdomen odaklı ultrasonografik değerlendirme (AFAST), hekimin hedef organda serbest sıvı ve yumuşak doku anormallikleri olup olmadığını hızlı bir şekilde tespit etmesini sağlayan ilk basamak tarama yöntemidir. Bu test, serbest sıvının acil durumlarda hızlı bir şekilde tespit edilmesi için sıklıkla kullanılmaktadır, fakat aynı zamanda FIP'e bağlı serbest sıvı olduğu düşünülen kedilerde hasta başında ultrason (PoCUS) taraması olarak da kullanılabilir. Ultrason probunun karnın dört farklı yerine yerleştirilmesiyle uygulanan bu tekniğin öğrenilmesi nispeten daha kolaydır. Ayrıca, AFAST hızlı (<3 dakika), gerçek zamanlı bir görüntüleme yöntemidir ve hasta üzerindeki olumsuz etkileri azdır(134). Birçok kedi başlangıçta belirgin şekilde abdominal sıvı dalgası ile karşımıza çıkmadığından veya hastalıkları öncelikle effüzyonsuz iken sonra effüzyonlu hale geçtiğinden, arka arkaya yapılan AFAST muayeneleri bu vakaları teşhis etmek için mükemmel bir araçtır.
Şekil 18-21 anekoik serbest sıvıyı gösteren pozitif AFAST görüntüleridir (her görüntünün [a] yanında birebir aynı, işaretlenmiş versiyonu da [b] bulunmaktadır).
Anekoik Serbest Sıvıyı Gösteren Pozitif AFAST Görüntüleri *
AFAST, serbest sıvının hızla tespit edilmesi için acil servis ortamında yaygın olarak kullanılan birinci basamak tarama yöntemidir. Ayrıca FIP'e bağlı serbest sıvı olduğundan şüphelenilen kedilerde hasta başında ultrason muayenesi yapmak için de kullanılabilir.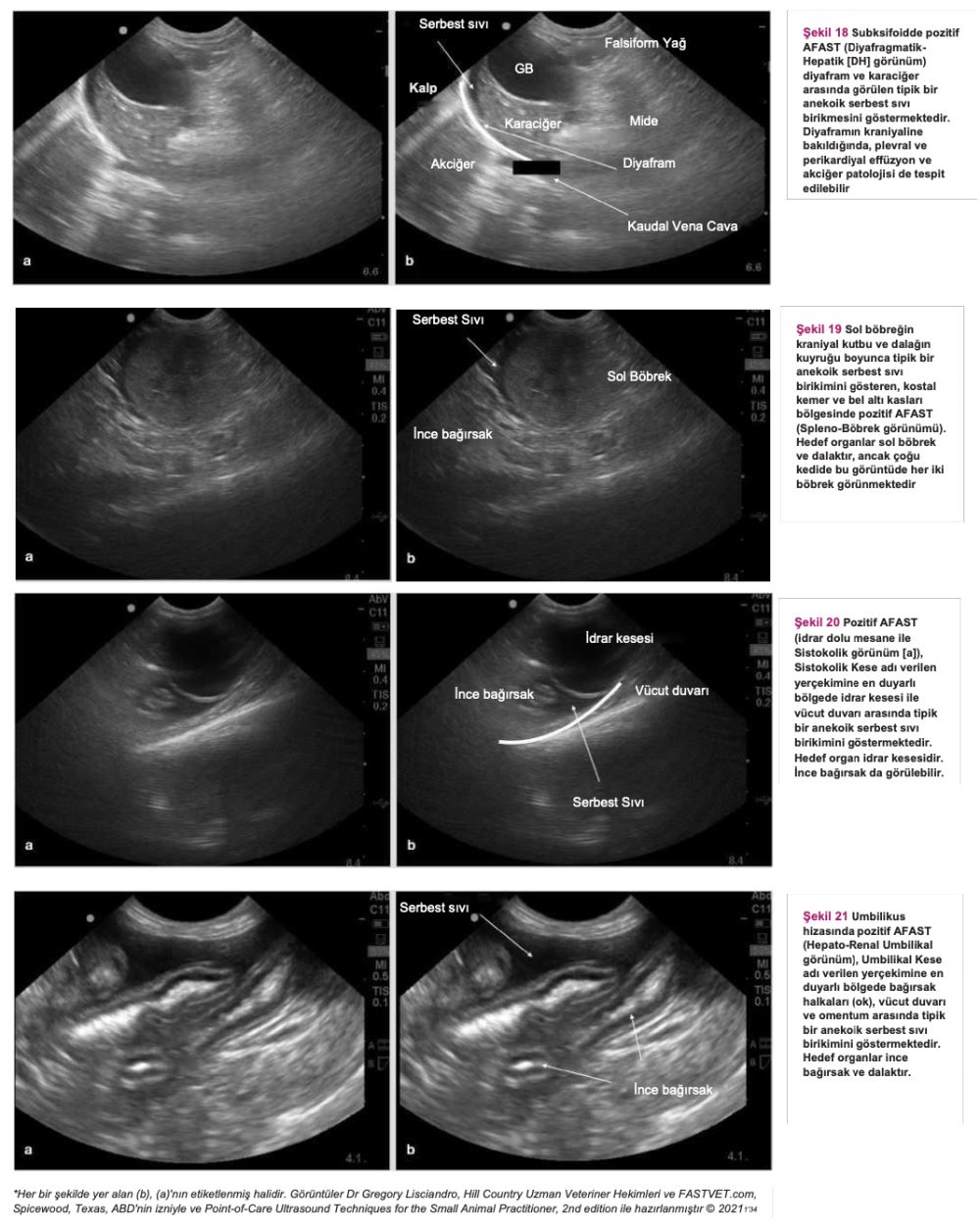
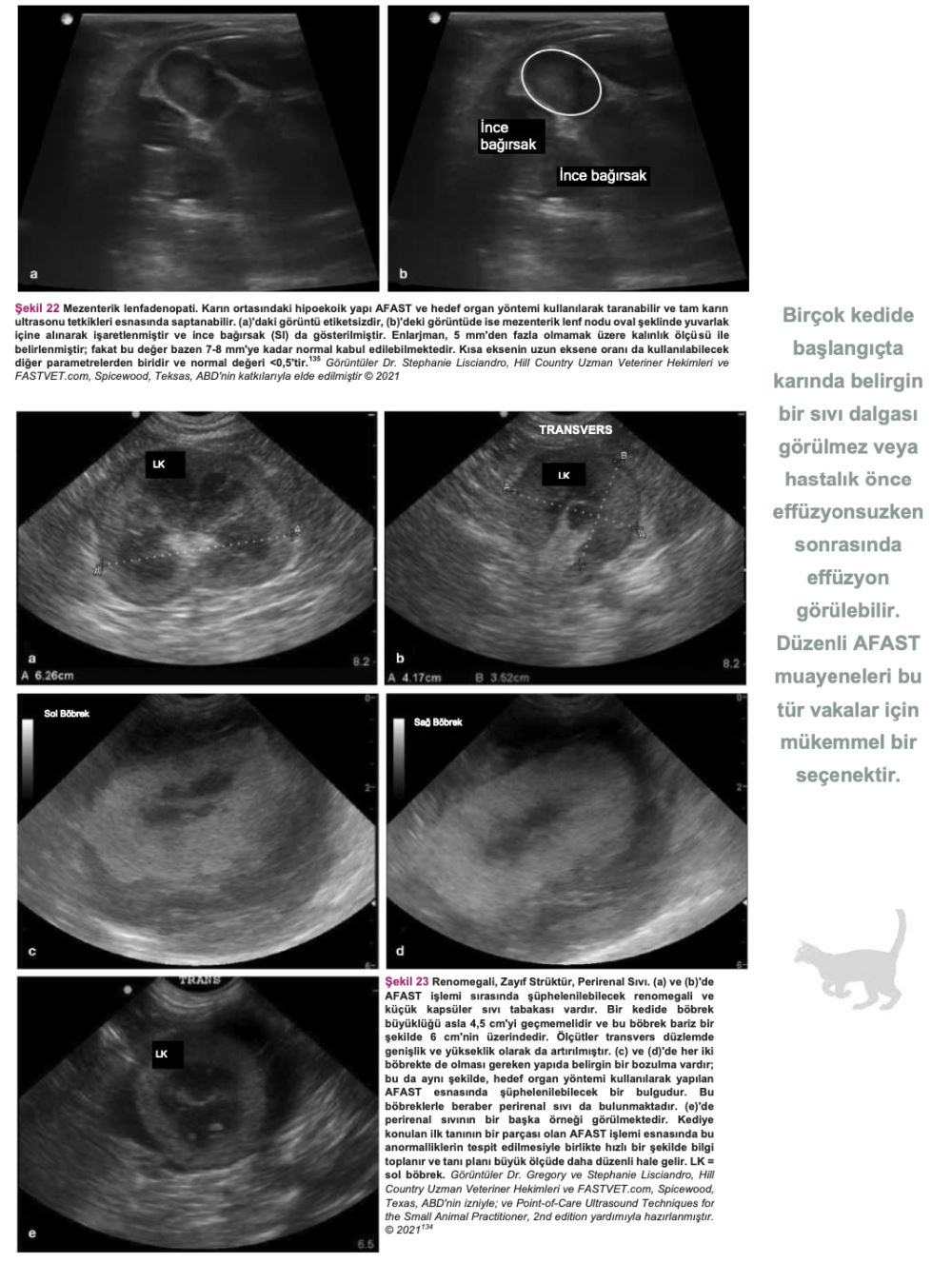


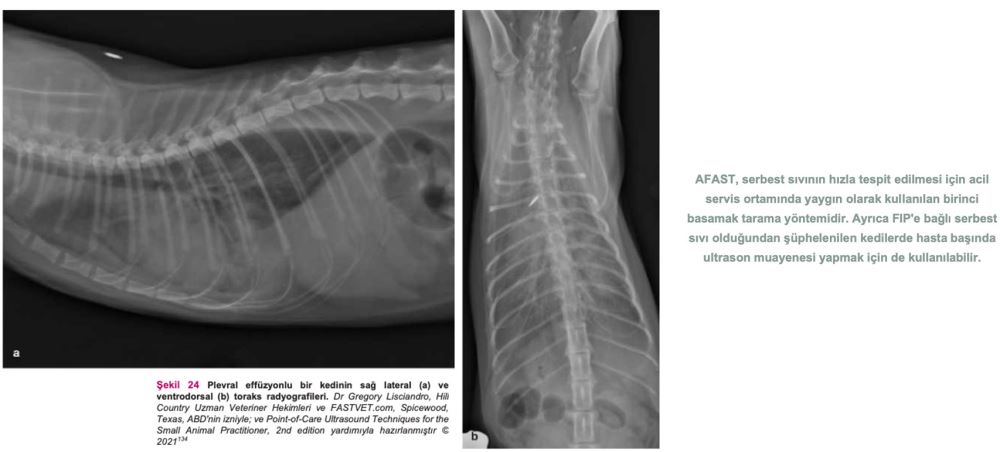
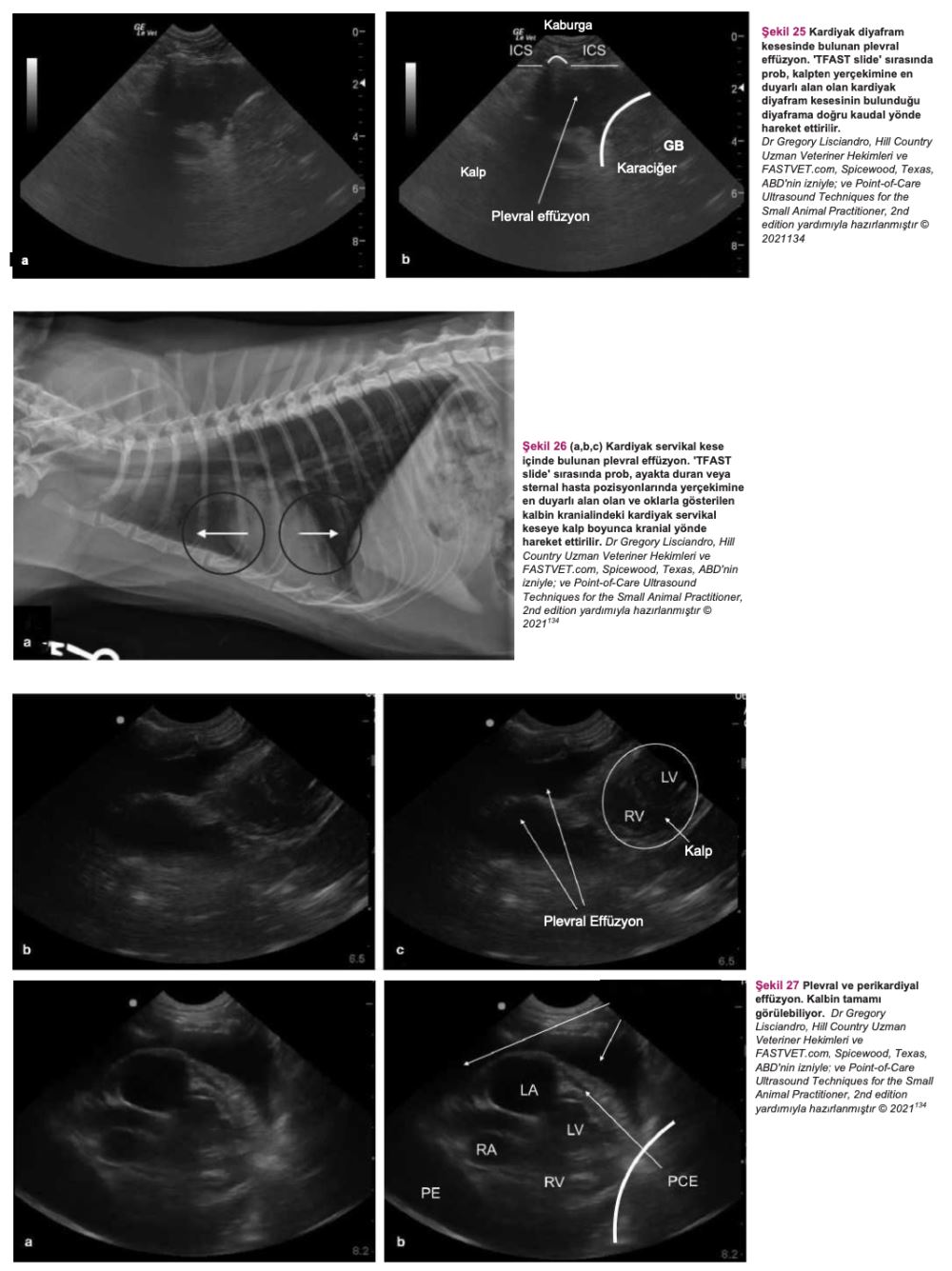
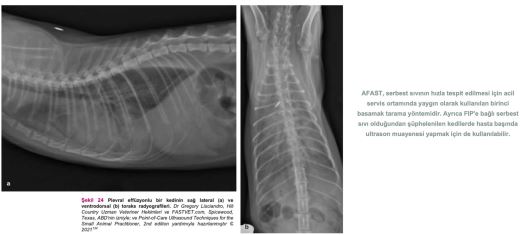
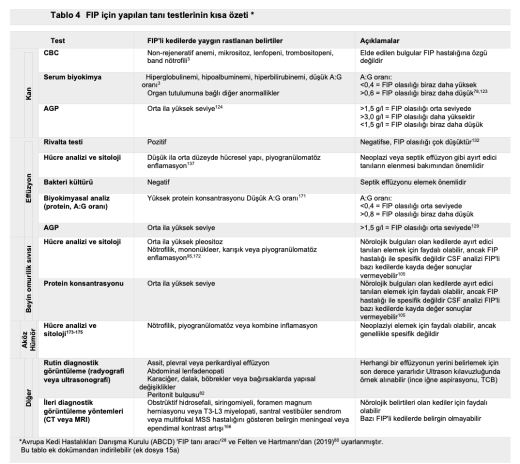
FIP olduğundan şüphelenilen bir kedide bu tür bulgular mevcutsa acilen sıvı örneği alınması ve tahlil yapılması gerekir. Serbest sıvı ve yumuşak doku anormallikleri tespitinde kullanılan AFAST, hem gözlem amaçlı hem de fizik muayenenin tamamlayıcısı olarak kullanılabilir(134). (Detaylı talimatlar için ek dosya 14'e bakınız.) Ayrıca, serbest sıvı tespit edilememişse ve öykü, belirtiler ve fizik muayene bulguları FIP'i kuvvetle düşündürüyorsa, tam abdominal ultrason muayenesi yapılmalıdır. FIP'in ante-mortem tanısında abdominal ultrasonun diyagnostik faydasını araştıran çalışmalar sınırlı sayıdadır. On altı kedide FIP ile bağlantılı abdominal ultrasonografi sonuçlarını gözden geçiren retrospektif bir çalışma, FIP söz konusu olduğunda abdominal lenfadenopati (mezenterik [Şekil 22], dalak vb.), renal yapıda görülen değişiklikler, effüzyon (peritoneal veya retroperitoneal [Şekil 23]) ve bağırsak yapısında görülen değişiklikler gibi bazı bulguların FIP'i ayırt edici tanı listesinin en üst sıralarına kadar yükseltmesi gerektiğini göstermiştir(82). Klinik tabloya, fizik muayene bulgularına, kullanılan görüntüleme ekipmanına ve veteriner hekimin hastanın klinik durumuna ilişkin yaptığı değerlendirmeye bağlı olarak, plevral effüzyondan şüpheleniliyorsa toraks radyografilerinin çekilmesi gerekebilir (Şekil 24). Kedi aşırı derecede dispneikse, ayakta lateral veya dorsoventral radyografik görüntüleme veya torasik PoCUS tercih edilir, çünkü bu kedilerin solunum durma riski yüksektir. Belirgin şekilde solunum güçlüğü olmayan ancak yine de sıvı birikimi olduğundan şüphelenilen vakalarda, abdominal effüzyonda olduğu gibi ultrasonun küçük miktarlardaki sıvıyı tespit etme olasılığı daha yüksek olduğundan, travmada toraks odaklı ultrasonografik değerlendirme (TFAST) yapılmalıdır (Şekil 25 ve 26)(85). (Ayrıntılı talimatlar için ek dosya 14'e bakınız.) AFAST DH görüntüsü, plevral effüzyon olup olmadığını belirlemek için sağ perikardiyal bölge (PCS) TFAST görüntüsü ile birleştirilebilir(134). Perikardiyal effüzyon FIP ile ilişkilendirilmekte ancak nadir rastlanmaktadır(70). Bununla birlikte, toraks radyografisi genellikle plevral effüzyon tanısı koymakta yardımcı olurken, perikardiyal effüzyon için altın standart kardiyak ultrasonografidir. Hiperekoik perikardın görülebilmesi için tüm kalp görüntülenir. Kalp ile kalp çevresi arasında sıvı birikmişse, kalbin apeksi yuvarlak görünür (Şekil 27)(134).
Histopatoloji
ÖNEMLİ BİLGİLER
❖ Genellikle asemptomatik olan FCoV enfeksiyonu kedilerin çoğunda yaygındır, çünkü virüs oldukça bulaşıcıdır ve fekal-oral bulaşma yoluyla hızla yayılır, bu da kedi yetiştirilen çiftlikler, barınaklar, kurtarma merkezleri ve hayvan bakım yerleri gibi çok kedili ortamlarda hastalığın yüksek oranda görülmesine neden olur.
❖ Özellikle effüzyon olmadığında, patognomonik klinik belirtiler ve laboratuar testlerinde herhangi bir değişiklik olmaması sebebiyle FIP tanısı koymak güç olabilir. Effüzyonu olmayan ante-mortem kediler için invazif olmayan doğrulayıcı bir test mevcut değildir. Aynı şekilde, FCoV ile enfekte kedilerin hangilerinde FIP gelişeceğini öngörecek bir teşhis prosedürü de bulunmamaktadır.
❖ FIP'li kedilerde tipik olarak iştahsızlık, letarji, artan/azalan ateş (genellikle antibiyotiklere yanıtsızdır), sarılık, lenfadenopati ve kilo kaybı veya yavrularda kilo alamama gibi spesifik olmayan klinik belirtiler görülür. Daha spesifik klinik bulgular arasında effüzyon, anterior üveit veya nörolojik bulgular yer almaktadır.
❖ FIP oluşumu için çeşitli risk faktörleri (konakçı, viral ve çevresel) tespit edilmiştir; bunlar arasında kedinin öyküsünde yakın zamanda yaşanan stresli bir olay da yer almaktadır.
❖ Hekimin, şüpheli bulgular indeksini 'adım adım' inşa etmesi için tanı testlerini ve numune türlerini seçerken hastanın bireysel öyküsünü, belirtilerini ve kapsamlı fizik muayene bulgularını göz önünde bulundurması gerekir.
❖ Sitolojik analiz için effüzyon boşluklarını aramak da dahil olmak üzere yapılan rutin muayeneler, teşhisi zor bir vakada kesinlikle gereklidir. Kedide effüzyon varsa, effüzyon ile yapılan testler genellikle kan ile yapılanlara oranla çok daha yüksek prediktif değere sahip olduğundan, FIP tanısı koymak çok daha kolay olabilir. Rivalta testi, FIP'i elemek için oldukça yüksek duyarlılığa (%91-100) sahip, effüzyon örneği ile yapılan kolay, hızlı ve ucuz bir testtir. Rivalta testi negatif çıkarsa, FIP'den ziyade efüzyona yol açan diğer potansiyel nedenler söz konusudur.
❖ Effüzyon yoksa, olası klinik bulguların çeşitliliği ve spesifik olmaması nedeniyle tanı koymak oldukça zor olabilir. FIP vakası değerlendirilirken her bir tanı testinin duyarlılığı, özgüllüğü, tahmin değeri, olabilirlik oranı ve tanısal doğruluğunun iyice anlaşılması son derece önemlidir. Herhangi bir tanı testine veya tıbbi laboratuvar profiline başvurmadan önce, hekim "neden bu test?" ve " elde edilen sonuçlar ne anlama geliyor?" sorularını cevaplayabilmelidir.
❖ PCR testini değerlendirirken, bir RT-PCR'nin diğeriyle aynı olmayabileceğini akılda tutmak önemlidir (örneğin, FCoV hedef dizilimi bakımından). Bir örneği göndermeden önce, klinisyenin, gönderilecek örnek seçimini kolaylaştırması için söz konusu tahlilin neyi hedeflediğine dair bilgi almak üzere laboratuvarla iletişime geçmesi önerilir.
❖ Diğer birçok kedi hastalığının aksine, kan örnekleri genellikle FIP teşhisinde yardımcı olmaz.
❖ FIP'i tam olarak teyit etmenin tek yolu doku içinde virüsü tespit etmektir (antijen boyama veya RT-PCR ile) ve bu da histopatoloji örneklerinin alınmasını gerektirir. Etkilenen dokuların makrofajlarında immün boyama yoluyla FCoV antijen tespiti, FIP teşhisi için altın standart olarak kabul edilmektedir.
Ek Bilgiler
Aşağıdaki dosyalar jfms.com adresinde çevrimiçi olarak mevcuttur ve catvets.com/fip ve everycat.org/aafp-fip-guidelines sayfalarından erişilebilir:
- Ek şekil 1: FCoV genomu.
- Ek şekil 2: FCoV serotip II'nin kökeni.
- Ek şekil 3: FCoV'nin fekal-oral yolla bulaşması.
- Ek şekil 4: (a-d) Düşük virülanslı FCoV enfeksiyonundan FIP ile bağlantılı FCoV'ye giden patogenez yolu.
- Ek dosya 5a: FIP patogenezi.
- Ek dosya 5b: Makrofaj aktivasyonu, kompleman aktivasyonu ve makrofajların antikor aracılı viral enfeksiyonu.
- Ek şekil 6: FCoV enfeksiyonuna karşı konakçı immün yanıtı.
- Ek dosya 7: İki çalışmada FIP görülen safkan kedi ırkları.
- Ek şekil 8: FIP için 'adım adım' diyagnostik çalışma.
- Ek dosya 9: Sağlık durumuyla ilgili hastalık öyküsü anketi.
- Ek video 10: Şekil 5'te gösterilen kedide ilerleyici nörolojik FIP.
- Ek video 11: Şekil 12'de gösterilen kedide FIP'e bağlı abdominal effüzyon.
- Ek dosya 12: FIP olduğundan şüphelenilen bir kedide komplike ayırt edici tanı vakası.
- Ek video 13: Rivalta testi uygulanıyor.
- Ek dosya 14: TFAST ve AFAST için gerekli açıklamalar.
- Ek dosya 15a: FIP için rutin tanı testleri - genel bakış.
- Ek dosya 15b: FIP tanısı için FCoV'nin doğrudan ve dolaylı olarak tespit edilmesi için kullanılan yöntemler - genel bakış.
- Ek dosya 16: FIP'in diyagnostik incelemesi: diyagnostik yaklaşım.
SÖZLÜK
❖ Kedi koronavirüsü (FCoV) Kedi enfeksiyöz peritonitine (FIP) neden olan şey kedi koronavirüsüdür (FCoV). FCoV'ler zarflı, pozitif sarmallı RNA virüsleridir ve yüzeylerinden çıkan sivri uçlar ile karakterize edilirler ve alışılmadık derecede büyük viral RNA genomlarına sahiptirler. FCoV, a-koronavirüs cinsine aittir..
- Biyotipler veya patotipler FCoV'ler, her biri farklı hedef konak hücrelere ve farklı hastalık potansiyellerine sahip iki biyotip (patotip) şeklinde tanımlanmaktadır. Bununla birlikte, tüm FCoV'ler sistemik olarak bulunabildiği ve çoğalabildiği için, mevcut literatür genellikle her iki biyotipi de FCoV olarak adlandırmaktadır.
- Kedi enterik koronavirüsü (FECV) genellikle FCoV ile birbirinin yerine kullanılan bir terimdir. FECV esas olarak enterik epitelde çoğalır ancak monositleri de enfekte edebilir ve monosit viremisi yoluyla sistemik olarak yayılabilir. FECV artık genellikle FCoV'nin 'daha az virülan', mutasyona uğramamış biyotip formu olarak adlandırılmaktadır.
- Kedi enfeksiyöz peritonit virüsü (FIPV) güncel olarak FCoV'nin FlP'e bağlı veya mutasyona uğramış virülan biyotip formu olarak tanımlanmaktadır. FIPV, FECV'nin enterositlerden monositlere/makrofajlara doğru değişen tropizmiyle ortaya çıkan internal mutasyonlar nedeniyle son derece ölümcül bir hastalığa neden olmaktadır.
- Her iki biyotip veya patotip (FECV ve FIPV) iki serotip (tip I ve tip II) şeklinde görülmektedir.
- Serotipler FCoV'nin I ve II olmak üzere iki serotipi vardır (kedi ve köpek koronavirüsü arasındaki spike [S] genindeki rekombinasyon ile tanımlanır). Her iki serotip de FIP'e neden olabilir.
Bu yayın, ‘’2022 AAFP/EveryCat Feline Infectious Peritonitis Diagnosis Guidelines’’ adlı makalenin Türkçe çevirisidir.
Makalenin orijinalini okumak ve kaynakça için tıklayın.